
���� ��1����ʣ���4.80g����ȫ��MnO2��m��KClO3��=16.60g-4.80g��
��2����ʣ���4.80g������MnO2��KCl�Ļ�����5gˮ�ܽ��Ȼ��صõ�����Һ�DZ�����Һ���ݴ˼������ܽ�ȣ���Ӧǰ���������ٵ�����Ϊ��������������������غ�����֮��Ĺ�ϵʽ��������ص�������
������Һ�������ܶȼ�����Һ������ٽ��c=$\frac{n}{V}$������Һ�����ʵ���Ũ�ȣ�
��3���ⶨ��Һ��n��K+����n��Cl-��=14��11�����������KOH��Ӧ��������غ�KCl��KClO��KCl���������������ķ�Χ��
��� �⣺��1����ʣ���4.80g����ȫ��MnO2��m��KClO3��=16.60g-4.80g=11.80g��
�ʴ�Ϊ��11.80��
��2����ʣ���4.80g������MnO2��KCl�Ļ�����5gˮ�ܽ��Ȼ��صõ�����Һ�DZ�����Һ��5gˮ�ܽ�KCl������=6.55g-4.80g=1.75g��
����100gˮ�ܽ�KCl������=$\frac{1.75g}{5g}$��100g=35g����25��ʱKCl���ܽ��35g��
��20gˮ�ܽ��Ȼ��ص�����=1.75g��4=7g����Ӧǰ���������ٵ�����Ϊ����������������������=16.60g-7g-4.80g=4.8g��������ԭ���غ��$\frac{\frac{4.8g}{16g/mol}}{3}$��122.5g/mol=12.25����ԭ�������KClO3������12.25g��
����Һ������=20g+7g=27g����Һ�����=$\frac{27g}{1.72g/mL}$��n��KCl��=$\frac{7g}{74.5g/mol}$������Һ�����ʵ���Ũ��=$\frac{\frac{7g}{74.5g/mol}}{\frac{27g}{1.72g/mL}}$=5.99mol/L��
������KCl��Һ���ܶ�Ϊ1.72g/cm3������Һ�����ʵ���Ũ��Ϊ5.99��
��3���ⶨ��Һ��n��K+����n��Cl-��=14��11���������Ϊ14mol��������11mol��
��������ȱ�ɸ�һ�۵ģ�һ����Ҫ�õ�11mol���ӣ����ʣ�µ�K����������غʹ�����أ�
�ɵ�ʧ�����غ��֪�������2mol�����������1mol��
���Եõ��ľ�����11molKCl��1molKClO��2molKClO3��
����ص�����������$\frac{2��122.5}{11��74.5+1��106.5+2��122.5}$��100%=0.212��
��������ȱ�ɸ�һ�۵ģ�һ����Ҫ�õ�11mol���ӣ�������Ϊ����غ��������صĻ����ɵ�ʧ�����غ���Եõ��������$\frac{11}{5}$=2.2mol��
����������14mol-11mol-2.2mol=0.8mol��
��������ص�����������$\frac{2.2��122.5}{11��74.5+2.2��122.5+0.8��56}$��100%=0.238��
�𣺵õ��Ĺ�����KClO3������������ȡֵ��ΧΪ0.212��0.238��
���� ���⿼���˻����ļ��㣬�漰���ʵ���Ũ�ȵļ��㡢�ܽ�ȵļ��㡢���ʼ�ķ�Ӧ��֪ʶ�㣬��������֮��Ĺ�ϵʽ���м��㣬ע����ԭ���غ���н����Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������������Ϊ��ԭ���� | |
| B�� | ��Ӧ����Һ��pH������ | |
| C�� | �������뻹ԭ�������ʵ���֮��Ϊ5��2 | |
| D�� | ÿת��2NA������ʱ��һ��������13.44 L������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CH2O��C2H4O2��C6H12O6 | B�� | C6H6O��C5H10��C7H6O2 | ||
| C�� | C2H4��C2H5OH��HOCH2CH2COOH | D�� | H2��CO��CH3OH |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
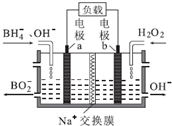
| A�� | ��ص�������ӦΪH2O2+2e-=2OH- | |
| B�� | ��طŵ�ʱNa+��a��������b���� | |
| C�� | ���Ӵӵ缫b�����·����缫a | |
| D�� | b���ҵ����Һ�������������a����ѭ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
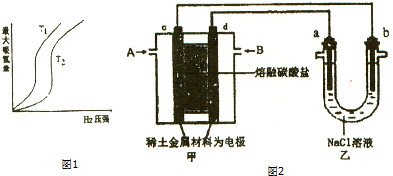
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ˮϡ��2��������Һ��pH����С | |
| B�� | ʹ�¶ȶ�����20�������Һ��pH������ | |
| C�� | �������Ĵ����ƾ��������pH������pH���� | |
| D�� | ��������п��ַ�Ӧ�������������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���Ƶ��γɹ��̣� | B�� | CCl4��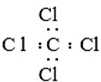 | ||
| C�� | ������N��N�� | D�� | ������̼��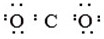 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CH4 | B�� | C2H6 | C�� | C3H6 | D�� | C3H8 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| n��SO32-����n��HSO3-�� | 91��9 | 1��1 | 1��91 |
| pH | 8.2 | 7.2 | 6.2 |

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com