
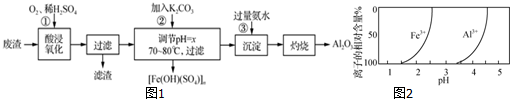
分析 废渣(Fe2O3、Al2O3和少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)[Fe(OH)(SO4)]n和高纯度的Al2O3,由流程可知,加硫酸溶解后,发生Fe2O3+6H+═2Fe3++3H2O、Al2O3+6H+═2Al3++3H2O、4FeS+3O2+12H+═4Fe3++4S+6H2O,滤渣为S、SiO2,过滤后滤液加碳酸钾调节pH,使铁离子转化为聚铁,然后滤液中加氨水生成沉淀为氢氧化铝,氢氧化铝灼烧生成氧化铝,以此来解答.
解答 解:废渣(Fe2O3、Al2O3和少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)[Fe(OH)(SO4)]n和高纯度的Al2O3,由流程可知,加硫酸溶解后,发生Fe2O3+6H+═2Fe3++3H2O、Al2O3+6H+═2Al3++3H2O、4FeS+3O2+12H+═4Fe3++4S+6H2O,滤渣为S、SiO2,过滤后滤液加碳酸钾调节pH,使铁离子转化为聚铁,然后滤液中加氨水生成沉淀为氢氧化铝,氢氧化铝灼烧生成氧化铝,
(1)酸浸时废渣中主要成分发生反应的一个离子方程式为Fe2O3+6H+═2Fe3++3H2O(或Al2O3+6H+═2Al3++3H2O);过程①中FeS转化为Fe3+和硫单质,写出此反应的离子方程式为4FeS+3O2+12H+═4Fe3++4S+6H2O,
故答案为:Fe2O3+6H+═2Fe3++3H2O(或Al2O3+6H+═2Al3++3H2O);4FeS+3O2+12H+═4Fe3++4S+6H2O;
(2)滤渣灼烧可得到纯度较高的晶体为二氧化硫,为酸性氧化物,具有还原性和漂白性,与A、B、D中均反应,只有C中溶液不褪色,故答案为:C;
(3)加入K2CO3,溶液中Fe3+、Al3+的相对含量的变化由图2可知,则x的值的范围为2.5~3.5.控制溶液的温度为70~80℃的目的是过高的温度不利于聚铁的形成(或Fe3+水解形成Fe(OH)3胶体或温度太低不利于水解,温度过高难于生成聚铁),
故答案为:2.5~3.5;过高的温度不利于聚铁的形成(或Fe3+水解形成Fe(OH)3胶体或温度太低不利于水解,温度过高难于生成聚铁);
(4)过程③中若用NaOH代替氨水会造成铝元素的损失,其原因是Al(OH)3+OH-═AlO2-+2H2O(或Al3++4OH-═AlO2-+2H2O),
故答案为:Al(OH)3+OH-═AlO2-+2H2O(或Al3++4OH-═AlO2-+2H2O).
点评 本题考查制备实验方案的设计,为高频考点,把握制备实验流程、混合物分离提纯方法、物质的性质和发生的反应为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案科目:高中化学 来源: 题型:选择题
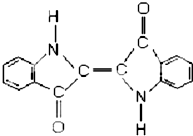
| A. | 靛蓝由碳、氢、氧、氮四种元素组成 | B. | 它的分子式是 C16H10N2O2 | ||
| C. | 该物质是苯的同系物 | D. | 它含有碳碳双键、羰基等官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
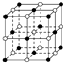 已知NaCl的摩尔质量为Mg•mol-1,晶体的密度为d g•cm-3,如图中Na+与最邻近的Cl-的核间距离为x cm,那么阿伏加德罗常数的值可表示为( )
已知NaCl的摩尔质量为Mg•mol-1,晶体的密度为d g•cm-3,如图中Na+与最邻近的Cl-的核间距离为x cm,那么阿伏加德罗常数的值可表示为( )| A. | 2Mx3d | B. | $\frac{M}{(2{x}^{3}d)}$ | C. | $\frac{4M}{({x}^{3}d)}$ | D. | $\frac{M}{({N}_{A}{x}^{3})}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将煤汽化和液化,得到清洁的燃料和化工原料 | |
| B. | 用CO2合成聚碳酸酯等可降解塑料,减少白色污染 | |
| C. | 加强生活污水的脱氮除磷的处理,遏制水体富营养化 | |
| D. | 研究采煤、采油新技术,尽量提高其产量以满足工业生产快速发展的需求 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | [Ag(NH3)2]OH的溶液中加入盐酸:Ag++Cl-═AgCl↓ | |
| B. | NaAlO2溶液中通入过量的CO2:2AlO2-+3H2O+CO2═2Al(OH)3↓+CO32- | |
| C. | 用Na2S2O3溶液吸收自来水中多余Cl2:4Cl2+S2O32-+5H2O═10H++2SO42-+8Cl- | |
| D. | 向酸性KMnO4溶液滴加H2C2O4(弱酸),溶液褪色:2MnO4++5H2C2O4═2Mn2++10CO2↑+2H2O+6OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的颜色随核电荷数的增加而加深 | |
| B. | 单质的熔、沸点随核电荷数的增加而升高 | |
| C. | 它们的氢化物的还原性随核电荷数的增加而增强 | |
| D. | 它们的氢化物的稳定性随核电荷数的增加而增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
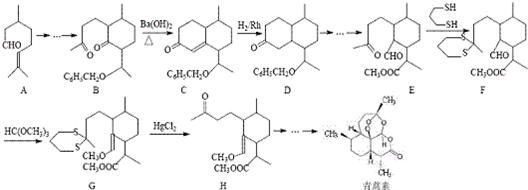
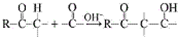
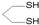 用系统命名法命名,它的名称是1,3-丙二硫醇;反应B→C,实际上可看作两步进行,依次发生的反应类型是加成反应、消去反应.
用系统命名法命名,它的名称是1,3-丙二硫醇;反应B→C,实际上可看作两步进行,依次发生的反应类型是加成反应、消去反应.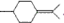 ,则异蒲勒醇的结构简式为:
,则异蒲勒醇的结构简式为: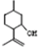 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的化学性质随着相对原子质量的递增而呈周期性变化 | |
| B. | 元素的最外层电子数等于元素的最高化合价 | |
| C. | 原子序数越大,原子半径越大 | |
| D. | 元素周期律是元素原子核外电子排布周期性变化的结果 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com