
【题目】下列物质中熔点最高的是( )
A.HgB.H2OC.WD.Na
科目:高中化学 来源: 题型:
【题目】磷酸铁(FePO42H2O,难溶于水的米白色固体)可用于生产药物、食品添加剂和锂离子电池的正极材料.实验室可通过下列实验制备磷酸铁.
(1)称取一定量已除去油污的废铁屑,加入稍过量的稀硫酸,加热、搅拌,反应一段时间后过滤.反应加热的目的是 .
(2)向滤液中加入一定量H2O2氧化Fe2+ . 为确定加入H2O2的量,需先用K2Cr2O7标准溶液滴定滤液中的Fe2+ , 离子方程式如下:Cr2O72﹣+6Fe2++14H+═2Cr3++6Fe3++7H2O
①在向滴定管中注入K2Cr2O7标准溶液前,滴定管需要检漏、和 .
②若滴定x mL滤液中的Fe2+ , 消耗a molL﹣1K2Cr2O7标准溶液b mL,则滤液中c(Fe2+)=molL﹣1 .
③为使滤液中的Fe2+完全被H2O2氧化,下列实验条件控制正确的是(填选项字母).
A.加入适当过量的H2O2溶液 B.缓慢滴加H2O2溶液并搅拌
C.加热,使反应在较高温度下进行 D.用氨水调节溶液pH=7
(3)将一定量的Na2HPO4溶液(溶液显碱性)加入含有Fe3+的溶液中,搅拌、过滤、洗涤、干燥得到FePO42H2O.若反应得到的FePO42H2O固体呈棕黄色,则磷酸铁中混有的杂质可能为 .
(4)磷酸亚铁锂LiFePO4是一种新型汽车锂电池,总反应为FePO4+Li ![]() LiFePO4 , 电池中的固体电解质可传导离子,放电时,正极反应为: .
LiFePO4 , 电池中的固体电解质可传导离子,放电时,正极反应为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会、生活密切相关,下列有关物质的用途和原理分析正确的是
选项 | 物质的用途 | 原理和分析 |
A | 漂白粉可用于食品漂白 | 漂白粉能使色素褪色 |
B | Al(OH)3可中和胃酸 | Al(OH)3是两性氢氧化物,与酸发生中和反应 |
C | Na2O2常作供氧化 | Na2O2在常温下能分解放出O2 |
D | 明矾可作净水剂 | 明矾溶于水后能消毒杀菌 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中正确的是
A. 漂白粉溶液在空气中失效:ClO-+CO2+H2O ===HClO+HCO3-
B. 用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-===Mn2++Cl2↑+2H2O
C. 将Fe2O3溶解于足量HI溶液:Fe2O3+6H+ ===2Fe3++3H2O
D. KI溶液与H2SO4酸化的H2O2溶液混合:2I-+H2O2+2H+===2H2O+I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将晶体X加热分解,可得A,B,D,E,F和水六种产物,其中A,B,D都是中学化学中常见的氧化物,气体E是单质F所含元素的氢化物.
(1)A能溶于强酸、强碱,写出A与强碱溶液反应的离子方程式 .
(2)B,D都是酸性氧化物且组成元素相同,D溶于水得强酸,则B、D分子中除氧元素外所含另一种元素在周期表中的位置是 .
(3)E能使湿润的红色石蕊试纸变蓝,实验室制取E气体的化学方程式为 , 制得的气体可用如图所示装置收集,则气体应从(填“A”或“B”)通入.
(4)由各分解产物的物质的量之比推测X的组成类似于明矾,则其化学式为 , 若向X的浓溶液中滴加浓NaOH溶液至过量,现象依次为、、 .
(5)取一定量的X晶体分解,若生成F 1mol,则必同时生成物质mol. 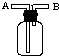
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铝粉与某铁的氧化物FeO2Fe2O3粉末配制成铝热剂,分成两等份.一份直接放入足量的烧碱溶液中,充分反应后放出气体在标准状况下的体积为15.68L;另一份在高温下恰好反应完全,反应后的混合物与足量的盐酸反应后,放出的气体在标准状况下的体积为( )
A.11.20L
B.15.68L
C.22.40L
D.31.36L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是一种重要的物质,可用于制取化肥和硝酸等.已知H﹣H键、N﹣H键、N≡N键的键能分别是436kJ/mol、391kJ/mol、946kJ/mol.
(1)写出合成氨的热反应方程式 .
生成1molNH3需要吸收或放出kJ
(2)当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如右图所示.图中t1 时引起平衡移动的条件可能是 . 其中表示平衡混合物中NH3的含量最高的一段时间是 . 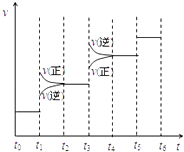
(3)温度为T℃时,将2a molH2和a molN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%.则该反应的平衡常数为 .
(4)已知373K时,可逆反应平衡常数为K=0.12,若某时刻时,测得 C(N2)=1mol/L,C(H2)=3mol/L,C(NH3)=2mol/L.此刻可逆反应
A.向正方向进行
B.向逆方向进行 C处于平衡状态.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X均为中学常见物质,它们在一定条件下有如下转化关系(副产物已略去)。
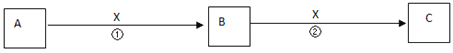
(1)若X是氧气,则A不可能______________A.CB.Si C.NaD.Mg
(2)若X是金属单质,向C的水溶液中滴入AgNO3溶液,产生了不溶于稀HNO3的白色沉淀,则B的化学式为__________;C溶液在贮存时应加入少量X,理由是(用离子方程式表示)___________ 。检验B溶液中阳离子的操作方法是_________________。
(3)若X是氢氧化钠溶液,A、B、C均为含铝元素的化合物,则反应②的离子方程式为________________
(4)若X为盐酸,A、B、C均不含铝元素,且反应②有无色无味气体生成,则反应①的离子方程式为___________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com