
【题目】将30mL 0.5mol/LNaOH溶液加水稀释到500mL,稀释后溶液中NaOH的物质的量浓度为( )
A.0.3 mol/LB.0.03 mol/LC.0.05 mol/LD.0.04 mol/L
科目:高中化学 来源: 题型:
【题目】表为周期表的一部分,其中的字母代表对应的元素,请针对这些元素回答下列问题. 
请回答下列问题:
(1)元素I的元素符号;已知M2+离子3d轨道中有6个电子,试推出M元素位于周期表的周期族.
(2)表中元素第一电离能最小的是(填元素符号,下同),电负性最大的是 , 化学性质最稳定的是 .
(3)表中元素处于d区的是(填元素符号).
(4)请举出F的金属性比C强的实验事实: , 并用原子结构理论解释其原因:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当固体AgCl放在较浓的KI溶液中振荡时,部分AgCl转化为AgI,其原因是( )
A.AgI比AgCl稳定
B.氯的非金属性比碘强
C.I﹣的还原性比Cl﹣强
D.AgI的溶解度比AgCl小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“稀土之父“徐光宪在《化学分子共和国》中介绍了许多物质,下列有关说法不正确的是
A. 固态CO2 俗称干冰,大量排放易造成温室效应
B. 碘单质“望酸碱而逃”指:碘单质遇碱歧化为I-和IO3-,再遇酸归中成碘单质
C. CO会引起煤气中毒,冬天用煤进行取暖时,在屋内放置一盆水,就可以有效防止中毒
D. NO自述“诞生在闪电的弧光中,强大的能量造就了我”指:高压放电情况下,N2和O2生成NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】每年10月23日上午6:02到晚上6:02被脊为“摩尔日"(Mole Day),这个时间的美式写法为6:0210/23,外观与阿伏加德罗常数6.02×1023相似。NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下22.4 LNO与11.2LO2 充分反应,产物的分子数为NA
B. 0.1mol/L的Na2SO4溶液中,SO42- 数目是0.1NA
C. 标准状况下.22.4L氯气与足量铁粉充分反应,转移的电子数为3NA
D. 0.1molCH4的核外电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】摩尔浓度相同的三种盐NaX、NaY和NaZ的溶液,其中pH值依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是( )
A.HX、HZ、HY
B.HZ、HY、HX
C.HX、HY、HZ
D.HY、HZ、HX
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有如下合成路线,甲经二步转化为丙,下列叙述不正确的是( ) 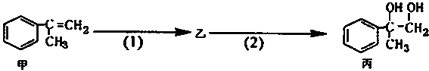
A.丙中可能含有未反应的甲,可用溴水检验是否含甲
B.反应(1)的无机试剂是液溴,铁作催化剂
C.甲和丙均可与酸性KMnO4溶液发生反应
D.反应(2)反应属于取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化砜(SO2Cl2)是一种重要的有机合成试剂,实验室可利用SO2与Cl2反应制取少量的SO2Cl2。装置如图(有些支持装置省略了)所示。
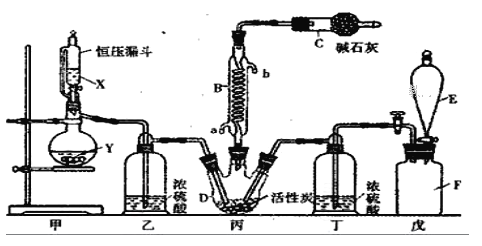
已知SO2Cl2的熔点为-54.1℃,沸点为69. 1℃;常温下比较稳定,受热易分解,遇水能发生剧烈的水解反应,产物之一为氯化氢气体。
(1)戊是贮气装置, F瓶中的气体能使湿润的有色布条褪色,则F瓶中的气体的实验室制法是________________________________(用方程式表示);
(2)B处反应管冷却水应从__________(填“a”或“b”)接口通入;C仪器的名称为____________,碱石灰的作用为____________。
(3)装置乙和丁的作用是____________;
(4)恒压漏斗具有特殊的结构,主要目的是___________;
(5)写出二氯化砜(SO2Cl2)水解反应的方程式________________;
(6)SO2溶于水生成亚硫酸,亚硫酸的酸性强于次氯酸,选用下面的装置和药品探究亚硫酸与次氯酸的酸性强弱:

装置连接顺序为A、_______、______、______、D、F,其中E的作用是____________,通过________________现象即可证明亚硫酸的酸性强于次氯酸。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com