
在25 ℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH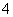 )=c(Cl-),则溶液显__________性(填“酸”、“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=_______________________________________。
)=c(Cl-),则溶液显__________性(填“酸”、“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=_______________________________________。
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
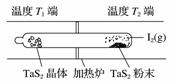
化学反应原理在科研和生产中有广泛应用。利用“化学蒸气转移法”制备TaS2晶体,发生如下反应:TaS2(s)+2I2(g)TaI4(g)+S2(g) ΔH>0(Ⅰ)。如图所示,反应(Ⅰ)在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净TaS2晶体,则温度T1________T2(填“>”、“<”或“=”)。上述反应体系中循环使用的物质是________。
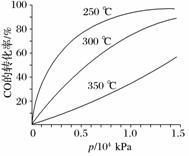
(2)[2011·山东理综,28(3)]CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH______0(填“>”或“<”)。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列中学常见实验的现象或表述正确的是 ( )。
A.过量的铁投入到一定量的稀硝酸中,充分反应后取上层清液于试管中,滴加KSCN溶液,溶液显血红色
B.制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁
C.检验红砖中的氧化铁成分,向红砖粉末中加入盐酸,充分反应后取上层清液于试管中,滴加KSCN溶液2~3滴即可
D.向CuSO4溶液中滴入过量NaOH溶液充分反应后,将混合液体倒入蒸发皿中加热煮沸一会,然后冷却、过滤,滤纸上的物体为“蓝色固体”
查看答案和解析>>
科目:高中化学 来源: 题型:
已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH??CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)的值增大,可以采取的措施是( )
A.加少量烧碱溶液 B.升高温度
C.加少量冰醋酸 D.加水
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
A.溶液中导电粒子的数目减少
B.溶液中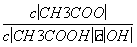 不变
不变
C.醋酸的电离程度增大,c(H+)亦增大
D.再加入10 mL pH=11的NaOH溶液,混合液pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组原子中,彼此化学性质一定相似的是( )
A.原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子
B.原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子
C.2p轨道上只有2个电子的X原子与3p轨道上只有2个电子的Y 原子
原子
D.最 外层都只有一个电子的X、Y原子
外层都只有一个电子的X、Y原子
查看答案和解析>>
科目:高中化学 来源: 题型:
已知具有碳碳双键结构的有机物可被碱性高锰酸钾溶液氧化成二元醇,如H2C===CH2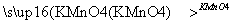 HOCH2CH2OH。现以CH2===C(CH3)2为原料按下列方式合成环状化合物D和高分子化合物G。
HOCH2CH2OH。现以CH2===C(CH3)2为原料按下列方式合成环状化合物D和高分子化合物G。
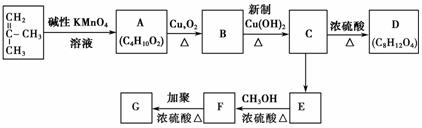
(1)A→B的反应类型是________,C→E的反应类型是________,E→F的反应类型是________。
(2)D的结构简式是________,G的结构简式是________。
(3)B→C的化学方程式是________________________________________________________________________。
(4)E→F的化学方程式是________________________________________________________________________。
(5)C物质的同分异构体中,与C所含官能团种类和数目都相同的同分异构体有________种(不包括C)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com