
| A. | 在100℃、101 kPa条件下,1 mol液态水汽化时需要吸收40.69 kJ的热量,则H2O(g)═H2O(l)的△H=+40.69 kJ•mol-1 | |||||||||
| B. | 已知CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJ•mol-1,则CH4的燃烧热△H=-890.3 kJ | |||||||||
| C. | H2(g)+Br2(g)═2HBr(g)△H=-72 kJ•mol-1其他相关数据如表:
| |||||||||
| D. | 已知S(g)+O2(g)═SO2(s)△H1,S(g)+O2(g)═SO2(g)△H2,则△H2<△H1 |
分析 A、根据化学方程式的书写方法以及气化吸热、液化放热来分析;
B、燃烧热的单位为kJ/mol;
C.根据反应热等于反应物的总键能减生成物的总键能计算;
D、固体硫变化为气态硫需要吸收热量.
解答 解:A、在100℃、101kPa条件下,1mol液态水气化时需要吸收40.69kJ的热量,即H2O(l)?H2O(g)△H=+40.69kJ•mol-1,则H2O(g)?H2O(l)的△H=-40.69kJ•mol-1,故A错误;
B、CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-802.33kJ/mol,则CH4的燃烧热为802.33kJ/mol,故B错误;
C.在H2(g)+Br2(g)═2HBr(g)△H=-72kJ•mol-1反应中,反应热等于反应物的总键能减生成物的总键能,即-72=436+a-2×369,a=230,故C正确;
D、固体硫变化为气态硫需要吸收热量,固体硫燃烧放出的热量少,但反应热都为负值,所以△H1<△H2 ,故D错误;
故选C.
点评 本题主要考查了反应热的概念、大小比较与计算,难度不大,注意概念的掌握.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 塑料、橡胶、合成纤维、酚醛树脂都属于有机高分子化合物 | |
| B. | 鸡蛋清中加入Na2SO4、CuSO4都会因盐析产生沉淀 | |
| C. | 油脂的皂化反应生成高级脂肪酸和丙醇 | |
| D. | 通过石油催化重整是获得烯烃的主要途径 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A.B,C,D,E五种元素,均位于元素周期表的前四周期.它们的核电荷数逐渐增加.且核电荷数之和为57;B原子的L层p轨道中有2个电子,C的原子核外有三个未成对电子,D与B原子的价电子数相同.E原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态.请回答下列问题:
A.B,C,D,E五种元素,均位于元素周期表的前四周期.它们的核电荷数逐渐增加.且核电荷数之和为57;B原子的L层p轨道中有2个电子,C的原子核外有三个未成对电子,D与B原子的价电子数相同.E原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态.请回答下列问题: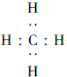 ,Y中D原子的杂化轨道类型为sp3杂化;C与A形成的常见化合物的分子构型为三角锥形.
,Y中D原子的杂化轨道类型为sp3杂化;C与A形成的常见化合物的分子构型为三角锥形.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
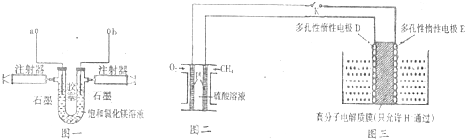
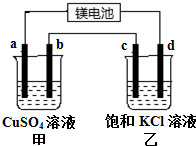 用一种镁二次电池(反应为:xMg+Mo3S4$?_{充电}^{放电}$MgxMo3S4)连接甲、乙装置进行电解.如图所示,a、b、c均为石墨电极,d为Fe电极,电解时d极有气体放出.下列说法不正确的是( )
用一种镁二次电池(反应为:xMg+Mo3S4$?_{充电}^{放电}$MgxMo3S4)连接甲、乙装置进行电解.如图所示,a、b、c均为石墨电极,d为Fe电极,电解时d极有气体放出.下列说法不正确的是( )| A. | 甲装置中a的电极反应为4OH--4e-═O2↑+2H2O | |
| B. | 放电时镁电池正极的电极反应为 Mo3S4+2xe-═Mo3S42x- | |
| C. | 当d极产生0.56 L(标准状况)气体时,b极增重3.2 g | |
| D. | 镁电池放电时,甲池中的SO42-移向a电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能说明非金属性Cl>C:2HClO3+CaCO3=Ca(ClO3)2+CO2↑+H2O | |
| B. | 能说明氧化性H2O2>Fe3+:2Fe2++H2O2+2H+=2Fe3++2H2O | |
| C. | 向Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O=2SO32-+4Cl-+6H+ | |
| D. | 铅酸蓄电池充电时的负极反应:PbSO4+2H2O-2e-=PbO2+4H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com