
| A. | 简单离子半径:Z>W>X>Y | |
| B. | W、X形成的化合物中一定含有离子键 | |
| C. | 最简单氢化物的还原性:Z>W | |
| D. | 工业上常用电解熔融氯化物的方法制备X、Y的单质 |
分析 Q、W、X、Y、Z是原子序数依次增大的短周期元素,Q和Y均满足主族序数与周期序数相等,则Q为H,Y为Al;Q与X、W与Z同主族,Q和W能形成原子个数之比为1:1和2:1的常见无机化合物,W为O,可形成双氧水、水两种氧化物,结合原子序数及位置可知,X为Na,Z为S,以此来解答.
解答 解:由上述分析可知,Q为H,W为O,X为Na,Y为Al,Z为S,
A.电子层越多,离子半径越大,具有相同电子排布的离子中原子序数大的离子半径小,则简单离子半径:Z>W>X>Y,故A正确;
B.W、X形成的化合物为氧化钠或过氧化钠,一定含有离子键,故B正确;
C.非金属性O>S,则最简单氢化物的还原性:Z>W,故C正确;
D.氯化铝为共价化合物,不导电,则工业上常用电解熔融氧化铝的方法制备Y,电解熔融氯化钠制备X,故D错误;
故选D.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的位置、原子结构、元素化合物来推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | NaOH是氧化产物 | B. | 该反应电子转移数为2e- | ||
| C. | NaH为还原剂 | D. | H2O既是还原剂又是氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6 g Fe和足量的盐酸完全反应失去电子数为0.3 NA | |
| B. | 1mol.L-1 K2SO4溶液所含K+数目为2NA | |
| C. | 1 mol钠与氧气反应生成Na2O或Na2O2时,失电子数目均为N A | |
| D. | 常温常压下,2.24L CO 和CO2 混合气体中含有的碳原子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯、氯乙烯、聚乙烯均可使酸性高锰酸钾溶液褪色 | |
| B. | 乙酸与乙醇可发生酯化反应,均可与金属钠发生置换反应 | |
| C. | 分馏、干馏都是物理变化,裂化、裂解都是化学变化 | |
| D. | 石油经过分馏得到多种烃,煤经过分馏可制焦炭、煤焦油等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 将各1mol的三种物质分别与氢氧化钠溶液充分反应,阿司匹林消耗氢氧化钠最多 | |
| B. | 三种有机物苯环上的氢原子若被氯原子取代,其一氯代物都只有2种 | |
| C. | 三种有机物中的所有原子不可能共平面 | |
| D. | 三种有机物都能与浓溴水发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CuSO4和Cu(NO3)2是自然界中重要的铜盐.请回答下列问题:
CuSO4和Cu(NO3)2是自然界中重要的铜盐.请回答下列问题: (用箭头表示出配位键的位置)
(用箭头表示出配位键的位置)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫酸是一种重要的基本化工原料,我国的硫磺资源相对短缺,主要用黄铁矿(FeS2,其中S为-1价)生产硫酸的重要原料,生产过程中主要有三个步骤:
硫酸是一种重要的基本化工原料,我国的硫磺资源相对短缺,主要用黄铁矿(FeS2,其中S为-1价)生产硫酸的重要原料,生产过程中主要有三个步骤:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,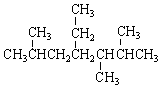 的名称为2,5,6-三甲基-4-乙基庚烷 的名称为2,5,6-三甲基-4-乙基庚烷 | |
| B. | 常压下,正戊烷、异戊烷、新戊烷的沸点依次增大 | |
| C. | 肌醇 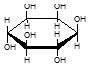 与葡萄糖 与葡萄糖 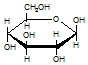 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 | |
| D. | 1.0 mol的 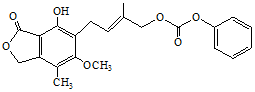 最多能与含5.0 mol NaOH的水溶液完全反应 最多能与含5.0 mol NaOH的水溶液完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2Br$→_{△}^{HBr溶液}$CH2BrCH2Br | |
| B. | CH3CH2Br$\stackrel{Br_{2}}{→}$CH2BrCH2Br | |
| C. | CH3CH2Br$→_{△}^{NaOH的乙醇溶液}$CH2=CH2$\stackrel{HBr}{→}$CH2BrCH3$\stackrel{Br_{2}}{→}$CH2BrCH2Br | |
| D. | CH3CH2Br$→_{△}^{NaOH的乙醇溶液}$CH2=CH2$\stackrel{Br_{2}}{→}$CH2BrCH2Br |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com