
向ZnSO4溶液中滴加饱和H2S溶液,没有沉淀生成,继续滴加一定量的氨水后,生成ZnS沉淀,用电离平衡原理解释上述现象。
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
下列关于催化剂的说法,正确的是( )
A.催化剂能使不起反应的物质发生反应
B.催化剂在化学反应前后,化学性质和质量都不变
C.催化剂不能改变化学反应速率
D.任何化学反应,都需要催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列装置中,MSO4和NSO4是两种常见金属的易溶盐。当K闭合时,SO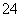 从右到左通过交换膜移向M极,下列分析正确的是(双选)( )
从右到左通过交换膜移向M极,下列分析正确的是(双选)( )
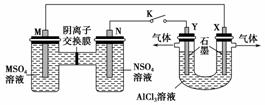
A.溶液中c(M2+)减小
B.N的电极反应式:N-2e-===N2+
C.X电极上有H2产生,发生还原反应
D.反应过程中X电极周围生成白色胶状沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
烟气脱硫能有效减少二氧化硫的排放。实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝[Al2(SO4)x(OH)6-2x]溶液,并用于烟气脱硫研究。

(1)酸浸时反应的化学方程式为________________;滤渣Ⅰ的主要成分为________(填化学式)。
(2)加CaCO3调节溶液的pH至3.6,其目的是中和溶液中的酸,并使Al2(SO4)3转化为Al2(SO4)x(OH)6- 2x。滤渣Ⅱ的主要成分为________(填化学式);若溶液的pH偏高,将会导致溶液中铝元素的含量降低, 其原因是______________(用离子方程式表示)。
(3)上述流程中经完全热分解放出的SO2量总是小于吸收的SO2量,其主要原因是__________________;与吸收SO2前的溶液相比,热分解后循环利用的溶液的pH将________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
溶液的酸碱性和pH:
(1)25 ℃,0.01 mol·L-1的盐酸中,c(OH-)=________ mol·L-1,pH=____________,由水电离出的c(H+)=________。
(2)100 ℃时,pH=6的水中c(H+)=________ mol·L-1,该水显________性。
(3)100 ℃时(Kw=10-12),0.01 mol·L-1的NaOH溶液的pH为________________,由水电离出的c(OH-)=________。
(4)25 ℃时,pH=8的CH3COONa溶液中c(OH-)=__________________,由水电离的c(OH-)=________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
H2S水溶液中存在电离平衡H2SH++HS-和HS-H++S2-。若向H2S溶液中 ( )
A.加水,平衡向右移动,溶液中氢离子浓度增大
B.通入过量SO2气体,平衡向左移动,溶液pH值增大
C.滴加新制氯水,平衡向左移动,溶液pH值减小
D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小
查看答案和解析>>
科目:高中化学 来源: 题型:
已知Ba2+有很强的毒性,医学上进行消化系统的X射线透视时,常使用BaSO4作内服造影剂。胃酸酸性很强(pH约为1),但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是______________________(用沉淀溶解平衡原理解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:
相同温度下等物质的量浓度的下列溶液中,c(NH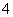 )最大的是( )
)最大的是( )
A.NH4Cl B.(NH4)2Fe(SO4)2
C.(NH4)2SO4 D.(NH4)2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下a mol·L-1稀氨水和b mol·L-1稀盐酸等体积混合,对混合后溶液判断一定正确的是( )
A.若a=b,则c(NH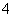 )=c(Cl-) B.若a>b,则c(NH
)=c(Cl-) B.若a>b,则c(NH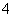 )>c(Cl-)
)>c(Cl-)
C.若a>b,则c(OH-)>c(H+) D.若a<b,则c(OH-)<c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com