
【题目】在强酸性溶液中能大量共存的无色透明离子组是( )
A.Mg2+ Na+ Cl﹣ SO42﹣
B.K+ Na+ CO32﹣ NO3﹣
C.K+ Na+ Cl﹣ Cu2+
D.Na+Ba2+OH﹣ SO42﹣
科目:高中化学 来源: 题型:
【题目】有以下物质相互转化

(1)A转化为B及气体这步反应中应加入的试剂是 。
(2)写出B的化学式 D的化学式 。
(3)写出由E转变成F的化学方程式 。
(4)写出鉴别G溶液所涉及的离子方程式 ;向G溶液中加入A的有关离子反应方程式是 。
(5)用G溶液腐蚀印刷电路板上的铜所发生的化学反应方程式为:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土化合物。以氟碳铈矿(主要含CeFCO3)为原料制备 CeO2的一种工艺流程如下:
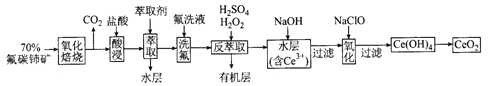
已知:①Ce4+能与F-结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;
②在硫酸体系中Ce4+能被萃取剂[(HA)2 ]萃取,而Ce3+不能。
回答下列问题:
(1)“氧化焙烧”前需将矿石粉碎成细颗粒,其目的是_____________。
(2)“酸浸”中会产生大量黄绿色气体,写出CeO2与盐酸反应的离子方程式:____________;为避免产生上述污染,请提出一种解决方案:_____________。
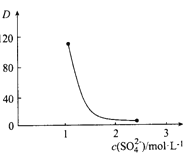
(3)“萃取”时存在反应:Ce4+ +n(HA)2![]() Ce·(H2n-4A2n)+4H+。实验室中萃取时用到的主要玻璃仪器名称为____________;下图中D时分配比,表示Ce(Ⅳ)分别在有机层中与水层中存在形式的物质的量浓度之比(
Ce·(H2n-4A2n)+4H+。实验室中萃取时用到的主要玻璃仪器名称为____________;下图中D时分配比,表示Ce(Ⅳ)分别在有机层中与水层中存在形式的物质的量浓度之比(![]() )。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因:__________。
)。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因:__________。
(4)“反萃取”中,在稀硫酸和H2O2的作用下CeO2转化为Ce3+。H2O2在该反应中作_________(填“催化剂”“氧化剂”或“还原剂”),每有1molH2O2参加反应,转移电子的物质的量为__________。
(5)“氧化”步骤的化学方程式为_____________。
(6)取上述流程中得到的CeO2产品0.4500 g,加硫酸溶解后,用0.1000mol/LFeSO4标准溶液滴定至终点时(铈被还原为Ce3+,其他杂质均不反应),消耗25.00 mL标准溶液。该产品中CeO2的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 因为p轨道是“8”字形的,所以p电子是“8”字形
B. 能层数为3时,有3s、3p、3d、3f四个轨道
C. 氢原子中只有一个电子,故氢原子只有一个轨道
D. 原子轨道与电子云都是用来形象描述电子运动状态的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下对影响反应方向的因素的判断错误的是( )
A. 有时焓变起决定性作用 B. 有时熵变起决定性作用
C. 焓变和熵变是两个主要因素 D. 温度不可能对反应方向起决定性作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表中16号元素和4号元素的原子相比较,前者的下列数据是后者的4倍的是( )
A. 电子数 B. 最外层电子数 C. 电子层数 D. 次外层电子数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com