
| A. | 加入氯化铵晶体 | B. | 加入氢氧化钠溶液 | ||
| C. | 加入硫酸溶液 | D. | 加入氯化钾晶体 |
分析 氨水中存在电离平衡NH3•H2O?NH4++OH-,若要使平衡向正反应方向移动,可以减小铵根离子或氢氧根离子浓度,如加入稀硫酸或驾驶稀释等,据此进行解答.
解答 解:A.加入氯化铵,溶液中铵根离子浓度增大,氨水的电离平衡向着逆向移动,故A错误;
B.加入氢氧化钠溶液后,溶液中氢氧根离子浓度增大,平衡向着逆向移动,故B错误;
C.加入稀硫酸,氢离子与氢氧根离子反应,导致氨水的电离平衡向着正向移动,故C正确;
D.加入氯化钾晶体,氯离子和钾离子不影响氨水的电离平衡,故D错误;
故选C.
点评 本题考查了弱电解质的电离平衡及其影响,题目难度中等,明确影响弱电解质电离平衡的因素为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案科目:高中化学 来源: 题型:解答题
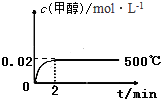 工业上合成甲醇的反应为:CO(g)+2H2(g)?CH3OH(g)△H<0.500℃,5MPa条件下,将0.20mol CO与0.58mol H2的混合气体充入2L恒容密闭容器发生反应,反应过程中甲醇的物质的量浓度随时间的变化如图所示
工业上合成甲醇的反应为:CO(g)+2H2(g)?CH3OH(g)△H<0.500℃,5MPa条件下,将0.20mol CO与0.58mol H2的混合气体充入2L恒容密闭容器发生反应,反应过程中甲醇的物质的量浓度随时间的变化如图所示查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:a>b>c>d | |
| B. | 离子半径:aAm+>bBn+>cCm->dDn- | |
| C. | 离子还原性:aA(n+1)+>bBn+,离子氧化性:cCm->dDn- | |
| D. | 单质还原性:B>A,单质氧化性:D>C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
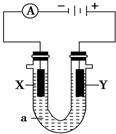 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学兴趣小组为了测定某草酸晶体的纯度及硫酸酸化的高锰酸钾溶液与草酸(H2C2O4)溶液反应的化学反应速率大小的影响因素,设计了如下实验.化学反应如下:
某化学兴趣小组为了测定某草酸晶体的纯度及硫酸酸化的高锰酸钾溶液与草酸(H2C2O4)溶液反应的化学反应速率大小的影响因素,设计了如下实验.化学反应如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A和B不可能是同系物 | |
| B. | A和B一定是同分异构体 | |
| C. | A和B最简式一定相同 | |
| D. | 等物质的量的A和B完全燃烧生成等质量的CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com