
【题目】钼(Mo)是一种重要的过渡金属元素,工业上由钼精矿(主要成分是MoS2)制备单质钼和钼酸钠晶体(Na2MoO42H2O)的流程如下:

(1) Na2MoO42H2O中Mo元素的化合价为____;钼精矿焙烧的主要反应中,氧化剂和还原剂物质的量之比为________。
(2)流程中由Na2MoO4溶液获得晶体的操作是_________、过滤、洗涤、干燥。加入Na2CO3溶浸时发生的主要反应的离子方程式为______________。
(3)操作1中,所得Na2MoO4溶液中含SO42+杂质,其中c(MoO42+)0.80mol/L,c(SO42-)=0.04mol/L在结晶前需加入Ba(OH)2固体以除去溶液中的SO42-。当 BaMoO4开始沉淀时,SO42-的去除率是______。[Ksp(BaSO4)=1.1×10-10、Ksp( BaMoO4)=4.0×10-8,溶液体积变化可忽略]
(4)工业上钼精矿在酸性条件下,加入NaNO3溶液,也可以制备钼酸钠,该法的优点是_____。
(5)高纯Mo可用于制造电池级MoS2,Li-MoS2电池是一种性能优异的二次电池,其电池反应为:xLi+nMoS2![]() Lix(MoS2)n,该电池放电时正极反应为______________;充电时Li+移动方向为________(填“由阳极移向阴极”或“由阴极移向阳极”)。
Lix(MoS2)n,该电池放电时正极反应为______________;充电时Li+移动方向为________(填“由阳极移向阴极”或“由阴极移向阳极”)。
【答案】+6 7:2 蒸发浓缩、冷却结晶 CO32-+MoO3=MoO42-+CO2↑ 94.5% 工艺简单(或能耗低,节约能源) nMoS2+xe-=(MoS2)nx- 由阳极区移向阴极区
【解析】
(1)根据Na为+1价,O为-2价,化合物在元素正负化合价代数和等于0计算;根据钼精矿焙烧时发生反应2MoS2+7O2![]() 2MoO3+4SO2,结合元素化合价变化与物质氧化性、还原性分析;
2MoO3+4SO2,结合元素化合价变化与物质氧化性、还原性分析;
(2)Na2MoO4晶体中有结晶水,所以从Na2MoO4溶液获得晶体的操作是蒸发浓缩、冷却结晶、过滤、洗涤、干燥,根据流程示意图书写反应方程式;
(3)根据据钼酸钡和硫酸钡的溶度积计算出溶液中SO42-的浓度,再计算出SO42-的去除率;
(4)从反应过程的步骤、能耗等分析;
(5)电池放电时是原电池,正极发生还原反应,根据物质在元素化合价的变化书写正极反应式;充电时是电解池,阳离子移向负电荷较多的电极区。
(1)根据Na为+1价,O为-2价,化合物在元素正负化合价代数和等于0可知Mo元素的化合价等于+6价;钼精矿焙烧时发生反应2MoS2+7O2![]() 2MoO3+4SO2,在该反应中,O元素的化合价由反应前的O2中的0价变为反应后MoO3、SO2中的-2价,化合价降低,获得电子,O2作氧化剂;Mo元素的化合价由反应前MoS2中的+2价变为反应后MoO3中的+3价,化合价升高,失去电子;S元素的化合价由反应前MoS2中的-1价变为反应后SO2中的+4价,化合价升高,失去电子,所以MoS2作还原剂,因此钼精矿焙烧的主要反应中,氧化剂和还原剂物质的量之比为7:2;
2MoO3+4SO2,在该反应中,O元素的化合价由反应前的O2中的0价变为反应后MoO3、SO2中的-2价,化合价降低,获得电子,O2作氧化剂;Mo元素的化合价由反应前MoS2中的+2价变为反应后MoO3中的+3价,化合价升高,失去电子;S元素的化合价由反应前MoS2中的-1价变为反应后SO2中的+4价,化合价升高,失去电子,所以MoS2作还原剂,因此钼精矿焙烧的主要反应中,氧化剂和还原剂物质的量之比为7:2;
(2) 由流程信息可知,Na2MoO4晶体中有结晶水、用结晶法获得,所以从Na2MoO4溶液获得晶体的操作是蒸发浓缩、冷却结晶、过滤、洗涤、干燥;根据流程示意图可知MoO3与Na2CO3反应产生Na2MoO4和CO2,则该反应的化学方程式为CO32-+ MoO3=MoO42-+CO2↑;
(3) c(MoO42+)=0.80mol/L,c(SO42-)=0.04mol/L,当 BaMoO4开始沉淀时,c(Ba2+)=![]() mol/L=5.0×10-8mol/L;此时溶液在c(SO42-)=
mol/L=5.0×10-8mol/L;此时溶液在c(SO42-)=![]() mol/L=2.2×10-3mol/L,所以SO42-的去除率=
mol/L=2.2×10-3mol/L,所以SO42-的去除率=![]() ×100%=94.5%。
×100%=94.5%。
(4)工业上钼精矿在酸性条件下,加入NaNO3溶液,也可以制备钼酸钠,采用该法制备步骤大大简化,反应工艺简单,而且反应在溶液中进行,不需要加热,所以反应能耗也大大降低,可以节约能源;
(5)根据电池反应:xLi+nMoS2![]() Lix(MoS2)n,可知中该电池放电时,MoS2在正极上获得电子,发生还原反应,正极的电极反应为nMoS2+xe-=(MoS2) nx-;Li+是阳离子,在充电时会向负电荷较多的阴极移动,Li+移动方向为由阳极移向阴极。
Lix(MoS2)n,可知中该电池放电时,MoS2在正极上获得电子,发生还原反应,正极的电极反应为nMoS2+xe-=(MoS2) nx-;Li+是阳离子,在充电时会向负电荷较多的阴极移动,Li+移动方向为由阳极移向阴极。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】电镀废液中Cr2O7可通过下列反应转化成铬黄(PbCrO4):
Cr2O![]() (aq)+2Pb2+(aq)+H2O(l)
(aq)+2Pb2+(aq)+H2O(l) ![]() 2PbCrO4(s)+2H+(aq) ΔH<0
2PbCrO4(s)+2H+(aq) ΔH<0
该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是 ( )。
A. 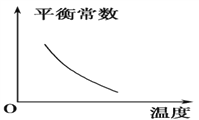 B.
B. 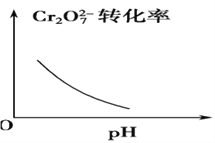
C.  D.
D. 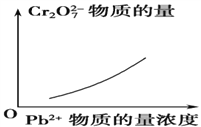
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养。实验室用食盐晶体与浓硫酸在微热条件下反应制取氯化氢气体。

(1)该反应的化学方程式为_________________________________________________,氯化氢气体的发生装置应该选择装置___________(填装置的编号,下同)。由于氯化氢气体有害,所以实验室用装置D来收集氯化氢,收集氯化氢时,气体从________管(填“a”或“b”)进入。用水吸收多余的氯化氢气体时,应该选择装置__________,这是为了_________________________________________________。
(2)要得到干燥的氯化氢气体,还需要在制取和收集装置之间插入一个装置D,此时D中装入的液体应该是______________________。
(3)气体发生在装置的选择要考虑反应物状态和反应条件等因素。
实验室制取氧气(氯酸钾和二氧化锰)和二氧化碳的发生装置都不用装置B,其原因分别是制取氧气时____________________________,制二氧化碳时___________________________。
(4)将标准状况下的200体积HCl气体溶于1体积水中,得到密度为1.12g/mL的盐酸,则该盐酸的物质的量浓度是_______________。 (保留两位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL1mol·L-1元酸HA溶液中,不断滴加1mol·L-1的NaOH溶液所加碱的体积与-lgc水(H+)的关系如图所示。c水(H+)为溶液中水电离的c(H+)。下列说法不正确的是

A. 常温下,Kα(HA)的数量级为10-4
B. a、b两点pH均为7
C. 从a点到b点,水的电离程度先增大后减小
D. 溶液的导电性逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E 都是前20号元素中的常见元素,且核电荷数递增。A原子没有中子;B原子次外层电子数与最外层电子数之差等于电子层数;C元素是地壳中含量最高的元素;4.6gD单质与足量盐酸作用可产生2.24LH2(标准状态下);E的一价阴离子的核外电子排布与Ar的核外电子排布相同。请回答下列问题:
(1)写出A、B、D的元素符号:A______;B_____;D______。
(2)C离子的电子式_______;E的离子结构示意图_______。
(3)写出电解D、E形成化合物的水溶液的化学反应方程式______。
(4)工业上将E的单质通入石灰乳[Ca(OH)2]制取漂粉精,化学反应方程式为______。漂粉精溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的某种物质,该化学反应方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要制备22.4L(标准状况)H2,现用质量分数为90.0%的锌粒与足量的稀盐酸反应(假设杂质不与稀盐酸反应),问:(要求写出计算过程)
(1)至少需要质量分数为90.0%的锌粒多少克?____
(2)生成的氯化锌的物质的量是多少?______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.葡萄糖在人体内的氧化反应是放热反应
B.某些物质在空气中燃烧是吸热反应
C.强酸、强碱的中和反应是放热反应,弱酸、弱碱的中和反应是吸热反应
D.铝分别与盐酸和稀硫酸反应,前者是放热反应,后者是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某微粒的结构示意图为![]() ,试回答:
,试回答:
(1)x表示______,y和微粒的电子层数共同决定了该微粒的________。
(2)当x-y=10时,微粒为_________(填微粒类别)。
(3)y=8时,该微粒带2 个单位负电荷,则该微粒的符号为_______,该微粒的结构示意图为_________。
(4)当y=1的中性原子M与y=7的中性原子N 化合时,形成的化合物的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知a、b、c、d四种短周期主族元素,在周期表中相对位置如下图所示,下列说法正确的是( )

A. a、c两元素的最高正价一定相等
B. d的原子序数不可能是b的原子序数的3倍
C. 若c元素最高价氧化物对应的水化物是强酸,则d元素的单质具有强氧化性
D. c的最高价氧化物对应的水化物可溶于d的最高价氧化物对应的水化物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com