
| 步骤Ⅰ |
| Mg,800℃,Ar |
| 步骤II |
| ||
| Ar |
| ||
| Ar |
| ||
| Ar |
| ||
| Ar |


 学业测评一课一测系列答案
学业测评一课一测系列答案 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案科目:高中化学 来源: 题型:
 常温下钛的化学活性很小,在较高温度下可与多种物质反应.
常温下钛的化学活性很小,在较高温度下可与多种物质反应.
| >400℃ | 约1250℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| Mg.800℃.Ar |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省苏州市高三调研测试化学试卷(解析版) 题型:计算题
常温下钛的化学活性很小,在较高温度下可与多种物质反应。
(1)工业上由金红石(含TiO2大于96%)为原料生产钛的流程如下:

① 沸腾氯化炉中发生的主要反应为: 。
② 已知:Ti(s) +2Cl2(g)=TiCl4(l) ΔH=a kJ·mol-1;
2Na(s) +Cl2(g)=2NaCl(s) ΔH=b kJ·mol-1;
Na(s)=Na(l) ΔH=c kJ·mol-1;
则TiCl4(l) +4Na(l)=Ti(s) +4NaCl(s) ΔH= kJ·mol-1。
③ TiCl4遇水强烈水解,写出其水解的化学方程式 。
(2)TiO2直接电解法生产钛是一种较先进的方法,电解质为熔融的氯化钙,原理如图所示,二氧化钛电极连接电 极,该极电极反应为: 。但此法会产生有毒气体,为减少对环境的污染,在电池中加入固体氧离子隔膜(氧离子能顺利通过),将两极产物隔开,再将石墨改为金属陶瓷电极,并通入一种还原性气体,该气体是 。

(3)海绵钛可用碘提纯,原理为: ,下列说法正确的是 。
,下列说法正确的是 。
A.该反应正反应的ΔH>0
B.在不同温度区域,TiI4的量保持不变
C.在提纯过程中,I2 的作用是将粗钛从低温区转移到高温区
D.在提纯过程中,I2 可循环利用
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山西省晋中市平遥中学高二(上)期中化学试卷(理科)(解析版) 题型:填空题
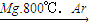 (步骤Ⅱ)Ti
(步骤Ⅱ)Ti查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com