
下列说法正确的是( )
|
| A. | 增大反应物浓度,可增大活化分子百分数,从而使有效碰撞次数增多 |
|
| B. | 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增大活化分子的百分数,从而使反应速率增大 |
|
| C. | 升高温度能使化学反应速率增大的主要原因是增加了反应物分子数 |
|
| D. | 催化剂能增大活化分子百分数,从而成千成万倍地增大化学反应速率 |
考点:
化学反应速率的影响因素.
专题:
化学反应速率专题.
分析:
A、增大反应物浓度,可增大单位体积内活化分子数,从而使有效碰撞次数增多,但是活化分子百分数不变;
B、根据增大压强(即缩小反应容器的体积),相当于增大了浓度分析;
C、升高温度能使化学反应速率增大的主要原因是分子能量增大,活化分子数增加,增加了活化分子百分数;
D、催化剂降低了反应所需能量,增加活化分子百分数,增大了反应速率.
解答:
解:A、由于增大反应物浓度,可增大单位体积内活化分子数,从而使有效碰撞次数增多,但是活化分子百分数不变,故A错误;
B、增大压强(即缩小反应容器的体积),增大了反应物生成物浓度,从而使反应速率增大,但是活化分子百分数不变,故B错误;
C、由于升高温度能使化学反应速率增大的主要原因是反应体系中分子能量增大,活化分子数增加,增加了活化分子百分数,反应物分子数不变,故C错误;
D、由于催化剂降低了反应所需能量,增加活化分子百分数,增大了反应速率,故D正确;
故选D.
点评:
本题主要考查了有效碰撞、化学反应的本质等,难度中等,根据课本知识即可完成.


 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
实验室用下面装置测定FeO和Fe2O3固体混合物中Fe2O3的质量,D装置的硬质双通玻璃管中的固体物质是FeO和Fe2O3的混合物.
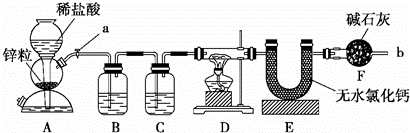
(1)如何检查装置A的气密性?
(2)装置A发生的反应有时要向其中加入少量CuSO4溶液,其目的是
(3)为了安全,在点燃D处的酒精灯之前,在b出口处必须 .
(4)装置B的作用是 ;装置C中装的液体是 .
(5)在气密性完好,并且进行了必要的安全操作后,点燃D处的酒精灯,在硬质双通玻璃管中发生反应的化学方程式是
(6)若FeO和Fe2O3固体混合物的质量为23.2g,反应完全后U型管的质量增加7.2g,则混合物中Fe2O3的质量为 g.
(7)U形管E右边又连接干燥管F的目的是 ,若无干燥管F,测得Fe2O3的质量将 (填“偏大”、“偏小”或“无影响”).
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中 ,与100 ml
,与100 ml  0.5 mol/L NaCl溶液所含的Cl-的物质的量浓度相同的是( )
0.5 mol/L NaCl溶液所含的Cl-的物质的量浓度相同的是( )
A、1 00 ml 0.5 mol/L MgCl2 溶液 B、200 ml 0.25 mol/L CaCl2溶液
00 ml 0.5 mol/L MgCl2 溶液 B、200 ml 0.25 mol/L CaCl2溶液
C、50  ml 1 mol/L NaCl溶液 D、200 ml 0.25 mol/L HCl溶液
ml 1 mol/L NaCl溶液 D、200 ml 0.25 mol/L HCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
在一固定体积的密闭容器中,充入2 mol CO2和1 mol H2发生如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数与温度(T)的关系如下表:
| T/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=__________________________________。
(2)若反应在830 ℃下达到平衡,则CO2气体的转化率为________。
(3)若绝热时(容器内外没有热量交换),平衡发生移动的结果是使容器内CO的浓度增大,则容器内气体温度______(填“升高”、“降低”或“不能确定”)。
(4)能判断该反应是否达到化学平衡状态的依据是______。
A.容器内压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
E.c(CO2 )·c(H2)=c(CO)·c(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
在2A+B═3C+4D反应中,表示该反应速率最快的是( )
|
| A. | v(A)=0.3mol/(L•s) | B. | v(B)=0.3mol/(L•s) |
|
| C. | v(C)=1.8mol/(L•min) | D. | v(D)=1mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图为化学反应:4NH3(g)+5O2(g)⇌4NO(g)+6H2O (g);△H<0 在一密闭容器中反应的v﹣t图.下列叙述不符合如图所给信息的是( )
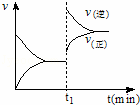
|
| A. | t1时,向容器中通入一定量的NO气体 |
|
| B. | t1时,缩小容器的体积 |
|
| C. | t1时改变外界单一条件时,该反应的平衡常数不一定变化 |
|
| D. | 从t1开始到新的平衡建立的过程中,平衡向逆反应方移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
甲~辛等元素在周期表中的相对位置如下表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )
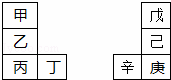
A. 金属性:甲>乙>丁
B. 原子半径:辛>戊>甲
C. 丙与庚的元素原子核外电子数相差13
D. 形成的最简单氢化物的稳定性:己>戊
查看答案和解析>>
科目:高中化学 来源: 题型:
下列与化学反应能量变化相关的叙述中正确的是( )
A. 已知CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=﹣802 kJ/mol,甲烷的燃烧热为802 kJ/mol
B. 等量H2在O2中完全燃烧,生成H2O(g)比生成H2O(l)放出的热量多
C. 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同
D. 由石墨比金刚石稳定可知:C(金刚石,s)═C(石墨,s)△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
关于离子键、共价键的各种叙述中,下列说法中正确的是( )
|
| A. | 在离子化合物里,只存在离子键,没有共价键 |
|
| B. | 非极性键只存在于双原子的单质分子(如Cl2)中 |
|
| C. | 原子序数为11与9的元素能够形成离子化合物,该化合物中存在离子键 |
|
| D. | 由不同元素组成的含多个原子的分子里,一定只存在极性键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com