
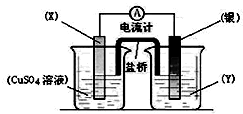
 用如图装置实现原电池反应:Cu+2Ag+═Cu2++2Ag
用如图装置实现原电池反应:Cu+2Ag+═Cu2++2Ag分析 根据反应“Cu+2Ag+=Cu2++2Ag”分析,Cu被氧化,失电子,应为原电池的负极,电极反应为Cu-2e-=Cu2+,则正极为活泼性较Cu弱的Ag,Ag+在正极上得电子被还原,电极反应为Ag++e=Ag,电解质溶液为AgNO3 ,根据电极方程式计算Ag的质量,若将盐桥换成一根铜丝,也象盐桥一样插入两个烧杯中,则左边烧杯构成电解池,右侧是原电池,据此回答.
解答 解:(1)由反应“2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)”可知,在反应中,Cu被氧化,失电子,X应为原电池的负极,为金属铜,Ag+在正极上得电子被还原,电解质溶液为AgNO3 ,
故答案为:Cu;AgNO3溶液;
(2)由反应“2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)”可知,在反应中,Cu被氧化,失电子,X应为原电池的负极,为金属铜,反应为:Cu-2e-=Cu2+,金属银是正极,发生银离子得电子的还原反应,电极反应为:Ag++e-=Ag.
故答案为:Cu-2e-=Cu2+;Ag++e-=Ag;
(3)电流从正极流向负极,即由Ag流向Cu;
故答案为:Ag;Cu;
(4)当线路中通过0.2mol电子时,由电极反应Ag++e-=Ag可知,生成Ag为0.2mol,其质量为21.6g,则银电极增重21.6g;
故答案为:增重;21.6.
(5)若将盐桥换成一根铜丝,也象盐桥一样插入两个烧杯中,则左边烧杯构成电解池,右侧是原电池,金属银是正极,左侧铜丝是阴极,电极上发生的反应是
Cu2++2e-=Cu,故答案为:Cu2++2e-=Cu.
点评 本题考查原电池的设计及工作原理,注意电极反应式的书写方法,牢固掌握原电池中电极的判断和电极反应式的书写的方法,侧重于基础知识的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由①可推测溶液中一定含大量CO32-、S2-、SO32-、NO3- | |
| B. | 由②可推测溶液中一定含大量NO2- | |
| C. | 由③可推测溶液中一定含大量NO3- | |
| D. | 由实验④难以推测溶液中一定含大量SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

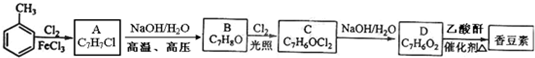
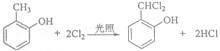 .
.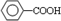 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
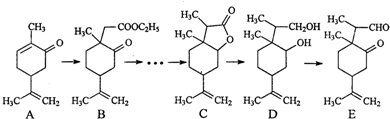
 (任写一种).
(任写一种).查看答案和解析>>
科目:高中化学 来源: 题型:选择题

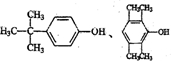
| A. | 菠萝酯不存在顺反异构现象 | B. | 原料中最多5个原子共线 | ||
| C. | 菠萝酯中所有的原子都可能共平面 | D. | 中间体和菠萝酯中均含手性碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
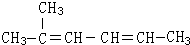 2-甲基-2,4-己二烯.
2-甲基-2,4-己二烯.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉与浓盐酸反应可制取氯气 | |
| B. | 用FeS与稀硝酸制取硫化氢 | |
| C. | 浓硫酸与碘化钠共热制取碘化氢 | |
| D. | 用浓溴水除去苯中溶有的少量的苯酚 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com