
| A. | 三种元素可组成CAB2和CAB3型化合物 | |
| B. | 离子半径:A3->B2->C+ | |
| C. | 氢化物稳定性:AH3>H2B | |
| D. | B的某种单质可用于杀菌消毒 |
分析 三种短周期元素A、B、C的原子序数依次增大,A3-与B2-、C+的电子层结构相同,AB在第二周期,C为第三周期,则A为N元素,B为O元素,C为Na元素,据此分析.
解答 解:三种短周期元素A、B、C的原子序数依次增大,A3-与B2-、C+的电子层结构相同,AB在第二周期,C为第三周期,则A为N元素,B为O元素,C为Na元素;
A.三种元素可组成NaNO2和NaNO3,故A正确;
B.电子排布相同的离子,原子序数越大,半径越小,则离子半径:A3->B2->C+,故B正确;
C.非金属性越强,其氢化物越稳定,非金属性:O>N,则氢化物稳定性:NH3<H2O,故C错误;
D.O元素的单质臭氧具有强氧化性,可用于杀菌消毒,故D正确.
故选C.
点评 本题考查原子结构与元素的性质,侧重于学生的分析能力的考查,注意把握原子结构与元素在周期表中的位置的关系,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 石油主要含烃类物质,这些烃类物质随着烃分子含有的碳原子数的增加沸点升高 | |
| B. | 常压分馏得到的汽油是混合物,没有固定的沸点,但石油气为纯净的丙烷 | |
| C. | 石油分馏不是化学变化,但裂化是化学变化 | |
| D. | 催化重整和加氢裂化可以提高汽油等轻质油的品质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用燃着的木条伸入集气瓶中检验二氧化碳 | |
| B. | 用水区分氢氧化钠固体和氯化钠固体 | |
| C. | 用铁粉除去FeSO4溶液中混有的CuSO4 | |
| D. | 用石灰水除去NaOH溶液中混有的Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
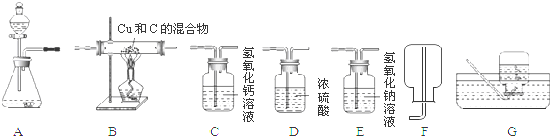
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子数为NA的CO和N2的混合气体体积为22.4L,平均相对分子质量为28 | |
| B. | 体积不变的容器中进行的反应N2+3H2$?_{高温高压}^{催化剂}$2NH3,随着反应的进行气体密度逐渐减小 | |
| C. | Na2O2和NH4Cl浓溶液反应得到混合气体的平均相对分子质量可能是34 | |
| D. | 对于反应I2(g)+H2(g)$\stackrel{△}{?}$2HI(g)而言,达到平衡后,气体的平均相对分子质量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
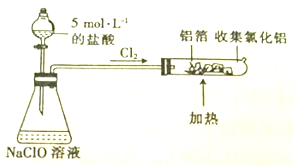
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两者都为s-sσ键 | B. | 两者都为p-pσ键 | ||
| C. | 前者为p-pσ键,后者为s-pσ键 | D. | 前者为s-sσ键,后者为s-pσ键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com