
二氧化硫(SO2) 在通常情况下是一种无色刺激性气味的有毒气体,它能与氢氧化钠溶液反应,生成盐和水,现有某一实验小组的同学欲利用下图装置和药品制SO2 。并对SO2 与水在通常情况下能否反应,进行实验探究,设计的探究过程如下。请回答其中的有关问题:
(1)假设:SO2与水在通常情况下能反应,生成物是一种酸。
(2)设计方案:先验证水能否使蓝色石蕊试纸变红;再验证SO2 气体能否使干燥的蓝色石蕊试纸变色;最后验证SO2 气体能否便湿润的蓝色石蕊试纸变红。
(3)查阅资料:你认为该研究小组需要查阅的资料内容包括 。
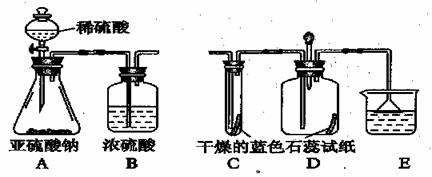
①二氧化硫易溶于水;②酸能使紫色石蕊试纸变红; ③二氧化硫能用浓硫酸干燥。
(4)实验:①实验过程中;装置C 内的石蕊试纸的颜色始终没有变化,这说明
②装置D中胶头滴管中的蒸馏水在二氧化硫气体生成之前滴到蓝色石蕊试纸上,未见试纸发生颜色变化,当有SO2 气体通过时,发现湿润的蓝色石蕊试纸变化。此现象说明 __________________________________。
③装置E 的作用是 __,
写出发生反应的化学方程式 ________
(5) 结论:原假设 (填“成立”或“不成立”) 。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
A.二氧化硫通入足量KOH溶液中SO2+2OH-![]()
![]() +H2O
+H2O
B.往澄清石灰水中通入足量二氧化硫SO2+Ca2++2OH-![]() CaSO3↓+H2O
CaSO3↓+H2O
C.往二氧化硫的水溶液中滴加少量NaOH溶液H2SO3+OH-![]()
![]() +H2O
+H2O
D.亚硫酸中滴加双氧水生成硫酸H2SO3+2H++![]()
![]() 2H++
2H++![]() +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
臭氧在地面附近的大气层中含量极少,在离地面
(1)带火星的木条伸入到盛有O3的集气瓶中,可以看到______________________________现象。
(2)写出在臭氧发生器中,O2转变为O3的化学方程式______________________________,氧气转变成臭氧的过程发生_______变化(填“物理”或“化学”)。
(3)应采取___________________方法保护臭氧层。
(4)二氧化硫(SO2)遇到O3微热,即被迅速氧化成为三氧化硫(SO3),SO3跟水反应生成硫酸,这是除去废气中SO2的理想方法。写出SO2与O3反应的化学方程式:____________________,并标出电子转移的方向和数目。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年辽宁省五校协作体高三上学期期中考试化学试卷(解析版) 题型:填空题
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%。目前,消除大气污染有多种方法。
(1)处理NOx的一种方法是利用甲烷催化还原NOx。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol—1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol—1
则甲烷直接将NO2还原为N2的热化学方程为 。
(2)降低汽车尾气的方法之一是在排气管上安装催化 转化器,发生如下反应:
2NO(g)+2CO(g) N2(g)+2CO2(g)
△H<0。
N2(g)+2CO2(g)
△H<0。
若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图所示,该反应的化学平衡常数为K= 。

若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,平衡将 移动(填“向左”、 “向右”或“不”)。
20min时,若改变反应条件,导致N2浓度发生如上图所示的变化,则改变的条件可能是 (填序号)。
①加入催化剂 ②降低温度 ③缩小容器体积 ④增加CO2的量
(3)肼(N2H4)用亚硝酸(HNO2)氧化可生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977。写出肼与亚硝酸反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2014届黑龙江省高二下学期期末考试化学试卷(解析版) 题型:填空题
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%。目前,消除大气污染有多种方法。
(1) 用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g) =4NO(g) + CO2(g) +2H2O(g) ⊿H= -574 kJ·mol-1
②CH4(g) +4NO(g) =2N2(g) + CO2(g) + 2H2O(g) ⊿H= -1160 kJ·mol-1
③H2O(g) = H2O(l) △H= -44.0 kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2 (g)、CO2 (g)和H2O(1)的热化学方程式 。
(2)利用Fe2+、Fe3+的催化作用,常温下可将SO2转化为SO42-,从而实现对SO2的治理。已知含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ = 4Fe3+ + 2H2O,则另一反应的离子方程式为 。
(3)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g) N2
(g)+CO2 (g) 。某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2
(g)+CO2 (g) 。某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
|
|
NO |
N2 |
CO2 |
|
0 |
1.00 |
0 |
0 |
|
10 |
0.58 |
0.21 |
0.21 |
|
20 |
0.40 |
0.30 |
0.30 |
|
30 |
0.40 |
0.30 |
0.30 |
|
40 |
0.32 |
0.34 |
0.17 |
|
50 |
0.32 |
0.34 |
0.17 |
①10min~20min以v(CO2) 表示的反应速率为 。
②根据表中数据,计算T1℃时该反应的平衡常数为 (保留两位小数)。
③一定温度下,随着NO的起始浓度增大,则NO的平衡转化率 (填“增大”、“不变”或“减小”) 。
④下列各项能作为判断该反应达到平衡的是 (填序号字母)。
A.容器内压强保持不变 B. 2v正(NO) = v逆(N2)
C.容器内CO2的体积分数不变 D.混合气体的密度保持不变
⑤30min末改变某一条件,过一段时间反应重新达到平衡,则改变的条件可能是 。请在下图中画出30min至40min 的变化曲线。

查看答案和解析>>
科目:高中化学 来源:2014届河北省高一下学期一调考试化学试卷(解析版) 题型:选择题
下列各物质的分类、名称(或俗名)、化学式都正确的是
A.金属氧化物 氧化铁 FeO B.非金属氧化物 二氧化硫 SO2
C.酸 硫酸 H2SO3 D.碱 纯碱 Na2CO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com