
| A. | Na2CO3溶液显碱性:CO32-+2H2O═H2CO3+2OH- | |
| B. | HS-电离的离子方程式:HS-+H2O═H3O++S2- | |
| C. | 少量氢氧化钙溶液与碳酸氢钠溶液混合,反应的离子方程式:Ca2++2HCO3-+2OH-═CaCO3+2H2O+CO32- | |
| D. | 在0.5 mol•L-1的K2Cr2O7溶液中存在如下平衡:Cr2O72-+H2O═2CrO42-+2H+,其平衡常数的表达式为$\frac{{{c^2}(CrO_4^{2-})•{c^2}({H^+})}}{{c(C{r_2}O_7^{2-})}}$ |
分析 A.碳酸根离子部分水解,应用可逆号,且分步水解,以第一步为主;
B.硫氢根离子为弱酸的酸式根离子,部分电离,应可逆号;
C.氢氧化钙少量,反应生成碳酸钙、碳酸钠和水;
D.化学平衡常数为生成物浓度幂之积比上反应物浓度幂之积.
解答 解:A.Na2CO3溶液显碱性:CO32-+H2O?HCO3-+OH-,故A错误;
B.HS-电离的离子方程式:HS-+H2O?H3O++S2-,故B错误;
C.少量氢氧化钙溶液与碳酸氢钠溶液混合,反应的离子方程式:Ca2++2HCO3-+2OH-═CaCO3+2H2O+CO32-,故C正确;
D.在0.5 mol•L-1的K2Cr2O7溶液中存在如下平衡:Cr2O72-+H2O═2CrO42-+2H+,其平衡常数的表达式为$\frac{{{c^2}(CrO_4^{2-})•{c^2}({H^+})}}{{c(C{r_2}O_7^{2-})}}$,故D正确;
故选:AB.
点评 本题考查了离子方程式的书写、电离方程式、水解离子方程式、化学平衡常数表达式的书写,题目难度不大,明确电解质强弱及电离方式、熟悉盐类水解规律、化学平衡常数表达式是解题关键,题目难度不大.


科目:高中化学 来源: 题型:实验题
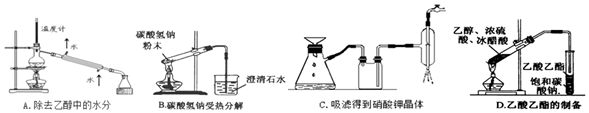
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 .下列有关柠檬烯的说法正确的是( )
.下列有关柠檬烯的说法正确的是( )| A. | 该物质常温下为液态,易溶于水 | |
| B. | 它的苯环上的一氯化物有4种 | |
| C. | 它的分子中所有的碳原子一定在同一平面上 | |
| D. | 一定条件下,它可以发生加成、取代、氧化等反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
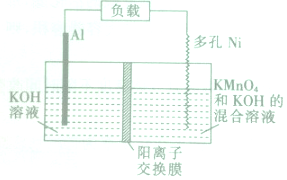 Licht等科学家设计的Al-MnO4-电池原理如图所示,电池总反应为Al+MnO4-═AlO2-+MnO2,下列说法正确的是( )
Licht等科学家设计的Al-MnO4-电池原理如图所示,电池总反应为Al+MnO4-═AlO2-+MnO2,下列说法正确的是( )| A. | 电池工作时,K+向负极区移动 | |
| B. | Al电极发生还原反应 | |
| C. | 正极的电极反应式为MnO4-+4H++3e-═MnO2+2H2O | |
| D. | 理论上电路中每通过1mol电子,负极质量减少9g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的标准燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)$?_{催化剂}^{500℃、30M}$2NH3(g)?△H=-38.6 kJ•mol-1 | |
| C. | S(s)+O2(g)═SO2(g)△H=-269.8 kJ•mol-1 | |
| D. | 2NO2═O2+2NO△H=+116.2 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盛装碱性试剂的试剂瓶应该使用橡皮塞 | |
| B. | 分离酒精和水可以采用分液法 | |
| C. | 蒸发结晶时应该将水分全部蒸干 | |
| D. | 在托盘天水左右托盘各放质量大小相同的纸,在左边纸上放氢氧化钠称量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com