
【题目】一定温度下将0.2mol气体A充入10L恒容密闭容器中,进行反应:2A(g)+B(g) ![]() 2C(g)+D(s) △H<0,一段时间后达到平衡,此反应过程中测定的数据如表所示,则下列说法正确的是( )
2C(g)+D(s) △H<0,一段时间后达到平衡,此反应过程中测定的数据如表所示,则下列说法正确的是( )
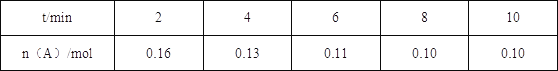
A.反应前2min的平均速率ν(C)=0.02molL﹣1min﹣1
B.平衡后降低温度,反应达到新平衡前ν(逆)>ν(正)
C.其他条件不变,10min后再充入一定量的A,平衡正向移动,A的转化率变小
D.保持其他条件不变,反应在恒压下进行,平衡时A的体积分数与恒容条件下反应相同
【答案】C
【解析】
A.由方程式可知,反应前2min内△n(C)=△n(A)=0.2mol﹣0.16mol=0.04mol,容器容积为10L,则v(C)=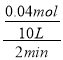 =0.002mol/(L·min),A错误;
=0.002mol/(L·min),A错误;
B.该反应的正反应为放热反应,降低温度,化学平衡向放热的正反应方向移动,反应达到新平衡前v(逆)<ν(正),B错误;
C.其他条件不变,10min后再充入一定量的A,A的浓度增大,平衡正向移动,但平衡移动的趋势是微弱的,达到新平衡时A的转化率变小,C正确;
D.该反应的正反应为气体物质的量减小的反应,恒温恒容下达平衡时压强减小,等效在恒温恒压下平衡基础上减小压强,化学平衡逆向移动,故恒温恒容下达到平衡时,A的体积分数增大,D错误;
故合理选项是C。


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案科目:高中化学 来源: 题型:
【题目】以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料制取氧化钴(Co2O3)的流程如下:
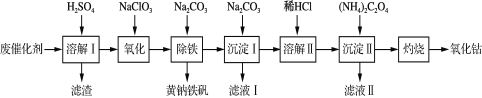
(1)溶解Ⅰ:溶解后过滤,将滤渣洗涤2~3次,洗液与滤液合并,其目的是___________ 。所得滤渣的主要成分是___________ (写化学式)。
(2) 氧化:加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,其离子方程式____________ 。
(3) 某研究小组为测定黄钠铁矾[NaxFey(SO4)m(OH)n]的组成,进行了如下实验:
①称取4.850 g样品,加盐酸完全溶解后,配成100.00 mL溶液A;
②量取25.00 mL溶液A,加入足量的KI (反应为2Fe3++2I-=2Fe2++I2),用0.250 0 mol·L-1 Na2S2O3溶液进行滴定(反应为I2+2Na2S2O3===2NaI+Na2S4O6),消耗30.00 mL Na2S2O3溶液至终点。
③另取25.00 mL溶液A,加足量BaCl2溶液充分反应后,过滤、洗涤、干燥后,得沉淀1.165 g。通过计算确定黄钠铁矾的化学式(写出计算过程) ____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应mX(g)![]() nY(g)+pZ(g) ΔH,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示,下列说法错误的是( )
nY(g)+pZ(g) ΔH,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示,下列说法错误的是( )
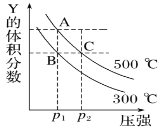
A. 该反应的ΔH>0
B. m<n+p
C. B、C两点化学平衡常数:KB>KC
D. A、C两点的反应速率v(A)<v(C)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2L的密闭容器中,加入4 molA和2molB进行如下反应:
3A(g)+2B(g)![]() 4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是( )
4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是( )
A. 前2min,D的平均反应速率为0.2mol/(L·min)
B. 此时,B的平衡转化率是40%
C. 增加B,平衡向右移动,B的平衡转化率增大
D. 增大该体系的压强,平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是极硬的银白色金属,主要用于冶炼各种合金钢和电镀。已知铬在自然界最重要的矿物是铬铁矿![]() 或
或![]() ,工业上制备较纯的金属铬的方法常用铝热法,其中一种简要流程。
,工业上制备较纯的金属铬的方法常用铝热法,其中一种简要流程。

![]() 如果在实验室模拟操作
如果在实验室模拟操作![]() ,应包括过滤和洗涤。实验室洗涤沉淀的操作是______。
,应包括过滤和洗涤。实验室洗涤沉淀的操作是______。
![]() 完成流程图中铬铁矿焙烧时的化学反应方程式______。
完成流程图中铬铁矿焙烧时的化学反应方程式______。
![]() 重铬酸钾为橙红色晶体,广泛用于鞣革、电镀、有机合成等领域。鞣革过程中,生皮中蛋白质发生了______而变得经久耐用。工业科用电解法来处理含
重铬酸钾为橙红色晶体,广泛用于鞣革、电镀、有机合成等领域。鞣革过程中,生皮中蛋白质发生了______而变得经久耐用。工业科用电解法来处理含![]() 废水,实验室利用如图装置模拟该法。电解过程中溶液里发生反应:
废水,实验室利用如图装置模拟该法。电解过程中溶液里发生反应:![]() 若某一时间段内溶液中减少了
若某一时间段内溶液中减少了![]() ,则这段时间电路中至少转移了______mol电子
,则这段时间电路中至少转移了______mol电子
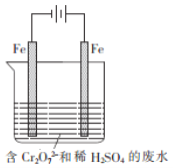
![]() 已知:
已知:
![]() 时
时![]() 溶液中仅存在两种含铬离子
溶液中仅存在两种含铬离子![]() 、
、![]() ,在溶液中存在:
,在溶液中存在:
![]() 黄色
黄色![]() 橙色
橙色![]()
![]()
![]() 时,
时,![]() 易溶于水,
易溶于水,![]() 难溶于水,且
难溶于水,且![]()
Ⅰ![]() 第
第![]() 步反应的下列状态一定达到平衡的是______
步反应的下列状态一定达到平衡的是______
![]() 和
和![]() 的浓度相同
的浓度相同
![]()
![]() 溶液的颜色保持不变
溶液的颜色保持不变
Ⅱ![]() 若将
若将![]() 的
的![]() 溶液和一定浓度的硝酸等体积混合,充分混合后溶液的
溶液和一定浓度的硝酸等体积混合,充分混合后溶液的![]() ,则此时溶液中两种含铬离子浓度之比
,则此时溶液中两种含铬离子浓度之比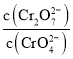 的近似值______,取此混合液1ml与
的近似值______,取此混合液1ml与![]() 的
的![]() 溶液混合,试判断混合溶液______
溶液混合,试判断混合溶液______![]() 填“能”或“不能”
填“能”或“不能”![]() 生成沉淀。
生成沉淀。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏伽德罗常数的值.下列有关叙述正确的是
为阿伏伽德罗常数的值.下列有关叙述正确的是![]()
A.硝酸与铜反应得到![]() 、
、![]() 共23g,则铜失去的电子数为
共23g,则铜失去的电子数为![]()
B.10g![]() 的乙醇水溶液中所含氢原子数目为
的乙醇水溶液中所含氢原子数目为![]()
C.标准状况下![]() 的平均相对分子质量为
的平均相对分子质量为![]() 的
的![]() 与
与![]() 含有中子数
含有中子数![]()
D.1molCu与足量的S完全反应,转移电子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯的叠氮酸(HN3)是一种弱酸,常温下向25mL 0.1 mol/L NaOH溶液中加入0.2 mol/L HN3溶液,滴加过程中的pH值的变化曲线(溶液混合时的体积变化忽略不计)如下图。下列说法正确的是( )

A. 该滴定过程中应用甲基橙作指示剂
B. 若B点pH=8,则c(HN3)=(10-6~10-8 )mol/L
C. 点D对应溶液中存在关系:c(HN3)>c(Na+)>c(N3-)
D. 沿曲线A→B→C的过程中,由水电离产生的c(OH-)逐渐减少
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com