

 .
.分析 Ⅰ.废水中砷元素主要以亚砷酸(H3AsO3)形式存在,加入硫化钠、硫酸亚铁除去过量的硫离子,过滤得到As2S3和FeS,滤液中加入过氧化氢和氧化钙,H2 O2与含砷物质发生氧化还原反应,氧化亚砷酸为砷酸,过滤得到砷酸铁、砷酸钙、氢氧化铁、沉淀硫酸钙等,
(1)根据化合物中化合价代数和为0计算;砷酸为弱酸,分步电离;
(2)As2 S3与过量的S2一反应,As2S3(s)+3S2-(aq)?2AsS33-(aq),根据化学平衡移动分析FeSO4的作用是沉淀过量的S2-沉砷效果;由流程可知:“二级沉砷”中H2O2与H3AsO3反应生成H3AsO4;
(3)流程分析可知钙离子结合硫酸根离子形成硫酸钙沉淀;
Ⅱ.(4)AsH3和氨气分子结构相同为共价化合物,砷原子和三个氢原子形成三个As-H键;
(5)步骤2中,H3As气体通人AgNO3溶液中,生成银镜和As2O3,结合电荷守恒和质量守恒书写;
(6)As的最低检出限为3.0x 10 -6g,取1g废渣样品,重复上述实验,未见银镜生成,取10g废渣样品最后生成银镜和As2 O3.则10g废渣含砷量最少为3.0x 10 -6g,据此分析.
解答 解:Ⅰ.(1)亚砷酸(H3AsO3)中氢元素+1价,氧元素-2价,化合物化合价代数和为0,则砷元素的化合价为+3价,第ⅤA族非金属元素形成最高价含氧酸中磷、砷形成的含氧酸都是弱酸,水溶液中分步电离,电离方程式为:H3AsO4?H++H2AsO4-,
故答案为:+3;H3AsO4?H++H2AsO4-;
(2)“一级沉砷”中FeSO4的作用是除去过量的硫离子,As2S3+3S2-?2AsS32-使平衡逆向进行,提高沉砷效果,“二级沉砷”中H2 O2与含砷物质发生氧化还原反应,氧化亚砷酸为砷酸;,反应的化学方程式为:H2AsO3+H2O2=H3AsO4+H2O,
故答案为:沉淀过量的S2-,使As2S3(s)+3S2-(aq)?2AsS33-(aq)平衡左移,提高沉砷效果;H3AsO3+H2O2=H3AsO4+H2O;
(3)流程分析可知,加入氧化钙和水反应生成氢氧化钙,氢氧化钙和砷酸反应生成砷酸钙沉淀、和铁离子反应生成氢氧化铁沉淀,钙离子结合硫酸根离子形成硫酸钙沉淀,所以沉淀X为CaSO4;
故答案为:CaSO4;
Ⅱ.(4)AsH3和氨气分子结构相同为共价化合物,砷原子和三个氢原子形成三个As-H键,电子式为:
故答案为:
(5)将AsH3气体通人AgNO3溶液中,生成银镜和As2O3,离子方程式为:12Ag++2H3As+3H2O═12Ag↓+As2O3+12H+;
故答案为:12,2,3;12,1,12;
(6)As的最低检出限为3.0x 10 -6g,取1g废渣样品,重复上述实验,未见银镜生成,取10g废渣样品最后生成银镜和As2 O3.则10g废渣含砷量最少为3.0x 10 -6g,则该废渣砷含量为(3.0×10 -6g÷10g)×1000g/kg=3.0×10-4g/kg,大于排入标准4.0×10-5g•kg-1,不符合排放标准;
故答案为:不符合;因为该废渣砷含量为(3.0×10 -6g÷10g)×1000g/kg=3.0×10-4g/kg,大于排入标准4.0×10-5g•kg-1.
点评 本题考查了物质制备方案设计,主要考查了化学方程式的书写、氧化还原反应、环境保护等,注意把握物质性质以及对题目信息的获取于使用,难度中等,侧重于考查学生的分析问题和解决问题的能量.


科目:高中化学 来源: 题型:推断题
 ,B是同周期第一电离能最小的元素,C的最外层有三个单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个单电子,E的外围电子排布式为3d64s2.回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液态氟化氢中有三聚氟化氢(HF)3分子存在 | |
| B. | 冰的密度比液态水的密度小 | |
| C. | H2O的分解温度比H2S高 | |
| D. | 乙醇能与水以任意比混溶而甲醚(CH3-O-CH3)难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11:3 | B. | 10:3 | C. | 4:3 | D. | 2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在0℃,1.01×105 Pa时,11.2 L氮气所含原子数目为NA | |
| B. | 标准状况下,5.6 L SO3的质量约为20 g | |
| C. | 同温同压下,16 g CH4与44 g CO2具有相同的体积 | |
| D. | 标准状况下,CO和N2的密度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯(CH3CH=CH2)在一定条件下加聚后可得聚丙烯: | |
| B. | 某塑料 可由CF2=CF2和CF2=CFCF3通过加聚反应制得 可由CF2=CF2和CF2=CFCF3通过加聚反应制得 | |
| C. | 合成高分子  的单体是CF2=CF2 的单体是CF2=CF2 | |
| D. | 一种全降解塑料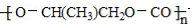 可由 可由  和 CO2在催化剂作用下加聚生成 和 CO2在催化剂作用下加聚生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com