
| 选项实验器材(省略夹持装置)相应实验 | 实验器材(省略夹持装置) | 相应实验 |
| A | 烧杯、玻璃棒、胶头滴管、分液漏斗 | 用溴水和苯除去NaBr溶液中少量NaI |
| B | 烧杯、玻璃棒、胶头滴管、滤纸 | 用盐酸除去硫酸钡中的少量碳酸钡 |
| C | 烧杯、玻璃棒、胶头滴管、容量瓶 | 用固体碳酸钠配制0.5mol/L的溶液 |
| D | 烧杯、玻璃棒、胶头滴管、酒精灯 | 硫酸铜溶液的浓缩结晶 |
| A、A | B、B | C、C | D、D |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、图2是滴定盐酸的曲线 |
| B、a与b的关系是:a<b |
| C、E点对应离子浓度由大到小的顺序为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| D、这两次滴定都可以用甲基橙作为指示剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③④ | B、①②③ |
| C、③④⑤ | D、②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、刚玉的主要成分是二氧化硅,红宝石、蓝宝石是含少量不同金属氧化物的优质刚玉 |
| B、蛋白质水解后只生成一种纯净的物质--氨基酸 |
| C、所有金属及其化合物在火焰上灼烧,都会使火焰呈现特征颜色,即焰色反应 |
| D、生铁比纯铁易受腐蚀,减少钢铁中的含碳量,可以增强钢铁的耐腐蚀能力 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
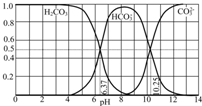 (1)三种弱酸HA、H2B、HC,电离常数为1.8×10-5、5.6×10-11、4.9×10-10、4.3×10-7(数据顺序已打乱),已知三种酸和它们的盐之间能发生以下反应:
(1)三种弱酸HA、H2B、HC,电离常数为1.8×10-5、5.6×10-11、4.9×10-10、4.3×10-7(数据顺序已打乱),已知三种酸和它们的盐之间能发生以下反应:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、①④ | C、②③ | D、③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com