
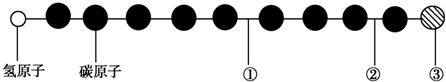
| A. | 该物质是烃的含氧衍生物 | B. | ①处的化学键是碳碳双键 | ||
| C. | ②处的化学键是碳碳单键 | D. | ③处的原子可能是氯原子或氟原子 |
分析 该分子为有机物,有机物分子中碳原子形成了4个共价键,从左边氢原子开始推断,第一个碳碳键为碳碳三键,第二个碳碳键为单键,第三个为三键,同理可推出①为碳碳三键,②为碳碳单键,③与其相连的碳应该为三键,即结构简式为:HC≡C-C≡C-C≡C-C≡C-C≡③,据此进行判断.
解答 解:A.该化合物不含O,因此不是烃的含氧衍生物,故A错误;
B.①处的键为碳碳三键,故B错误;
C.②处的键为碳碳单键,故C正确;
D.③原子形成的键为三键,所以不可能为氟原子或者氯原子,故D错误;
故选C.
点评 本题考查有机物中碳的成键特征,是对学生综合能力的考查与知识的运用,解题关键是根据有机物中碳原子形成的共价键数目推断有机物中存在的化学键,难度不大.


科目:高中化学 来源: 题型:解答题
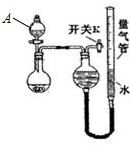 镁、铝、锌是生活中常见的三种金属,查阅资料获得如下信息:
镁、铝、锌是生活中常见的三种金属,查阅资料获得如下信息:| 编号 | 粉末质量 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 2.0 g | 10.0 mL | 346.2 mL |
| ② | 2.0 g | 10.0 mL | 335.0 mL |
| ③ | 2.0 g | 10.0 mL | 345.8 mL |
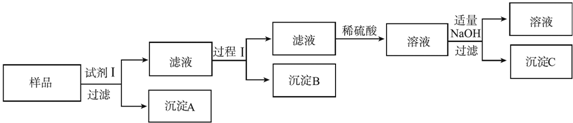
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)写出化学式FNH3,
(1)写出化学式FNH3,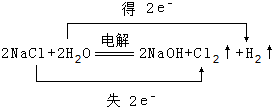 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2通入澄清石灰水中 | B. | 稀硝酸中加入铜片 | ||
| C. | 稀硝酸中加入铁屑 | D. | HCl溶液滴入Na2CO3溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol•L-1MgCl2溶液中的Mg2+数为NA | |
| B. | 1molNa2O2固体中含阴离子总数为2NA | |
| C. | 5g质量分数为46%的乙醇溶液中,氢原子的总数为0.6NA | |
| D. | 100mL12mol•L-1浓盐酸与足量MnO2加热反应,转移电子数为1.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
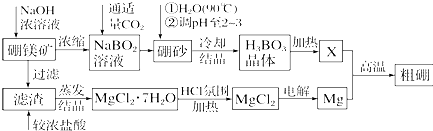
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn+1;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层电子数与B的相同,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn+1;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层电子数与B的相同,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):查看答案和解析>>
科目:高中化学 来源: 题型:解答题
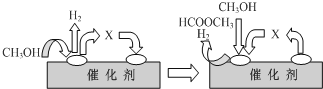
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com