
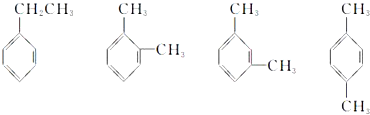
分析 (1)根据图示结构简式可知,四种有机物的分子式相同、结构不同,所以互为同分异构体;
(2)根据苯的同系物的习惯命名法进行命名;
(3)根据苯环上含有的等效氢原子数目进行判断其一氯代物种类.
解答 解:(1)根据有机物的结构简式可知,四种有机物具有相同的分子式、不同的结构,所以它们互为同分异构体,
故答案为:同分异构体;
(2) 这四种有机物都是苯的同系物,其名称分别为:乙苯、邻二甲苯、间二甲苯、对二甲苯,
这四种有机物都是苯的同系物,其名称分别为:乙苯、邻二甲苯、间二甲苯、对二甲苯,
故答案为:乙苯;邻二甲苯;间二甲苯;对二甲苯;
(3)乙苯分子的苯环上含有3种等效H原子,所以其一氯代物有3种;
邻二甲苯的苯环上含有2种等效H,所以其一氯代物有2种;
间二甲苯分子的苯环上含有3种等效H,所以其一氯代物有3种;
对二甲苯分子的苯环上含有1种等效氢原子,所以其一氯代物只有1种,
故答案为:3;2;3;1.
点评 本题考查了同分异构体的判断及数目的求算、有机物官能团的判断,题目难度不大,注意掌握常见有机物官能团名称、同分异构体的概念及书写方法,试题培养了学生灵活应用所学知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 收集氯气用排饱和食盐水的方法 | |
| B. | 加催化剂,使N2和H2在一定的条件下转化为NH3 | |
| C. | 可用浓氨水和氢氧化钠固体快速制取氨气 | |
| D. | 加压条件下有利于SO2和O2反应生成SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 | |
| 主要化合价 | 最高价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| 最低价 | -2 | -3 | -1 | -3 | |||||
| A. | 元素④和⑦的最高价氧化物的水化物的化学式不一定都为HRO3 | |
| B. | 元素③和⑥的最高价氧化物的水化物中,只有⑥的最高价氧化物的水化物能与Al(OH)3反应 | |
| C. | 元素①与元素②形成的化合物中不可能存在共价键 | |
| D. | 元素⑤的简单离子的半径是同周期主族元素简单离子中最大的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期的主族元素从左到右原子半径逐渐减小,它们形成简单的离子半径逐渐增大 | |
| B. | 可以根据主族元素原子的电子层数和最外层电子数确定其在周期表中的位置 | |
| C. | 由氟、氯两元素在周期表中位置关系推知,氟元素非金属性强于氯元素,所以氢氟酸的酸性应强于盐酸 | |
| D. | 在实际生产中,多在元素周期表的过渡元素区寻找新型半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
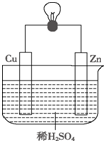 如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,做了如下记录,其中描述合理的是( )
如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,做了如下记录,其中描述合理的是( )| A. | ①②③ | B. | ③④⑥ | C. | ④⑤⑥ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨是重要的化工原料,用途广泛.
氨是重要的化工原料,用途广泛.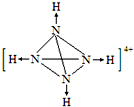 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com