
分析 (1)发生反应:Na2CO3+2HCl=2NaCl+H2O+CO2↑,所得溶液质量=样品质量+稀盐酸质量-二氧化碳的质量,据此计算生成二氧化碳的质量;
(2)根据方程式计算碳酸钠的质量,碳酸钠质量分数=$\frac{碳酸钠质量}{样品质量}$×100%.
解答 解:(1)发生反应:Na2CO3+2HCl=2NaCl+H2O+CO2↑,所得溶液质量=样品质量+稀盐酸质量-二氧化碳的质量,故生成气体的质量=6g+36.5g-40.3g=2.2g,
故答案为:2.2;
(2)设纯碱样品中Na2CO3的质量为x,则:
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 2.2g
所以x=$\frac{2.2g×106}{44}$=5.3g,
纯碱样品中Na2CO3的质量分数为:$\frac{5.3g}{6g}$×100≈88.3%,
答:纯碱样品中Na2CO3的质量分数为88.3%.
点评 本题考查混合物有关计算,关键是计算二氧化碳的质量,难度不大.


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:填空题
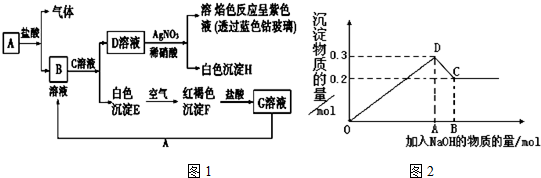
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚氯乙烯分子中含碳碳双键 | B. | 以淀粉为原料可制取乙酸乙酯 | ||
| C. | 戊烷有3种同分异构体 | D. | 油脂的皂化反应属于水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 组成和结构信息 |
| 甲 | 含有非极性共价键的常见二元离子化合物 |
| 乙 | 含有极性键和非极性键的18e-分子 |
| 丙 | 化学组成为BE,熔点高,可作超硬耐磨涂层材料 |
| 丁 | 化学组成为DBA4的离子化合物 |
 ;
; ,
,查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
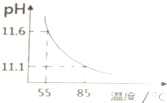
| A. | c(H+)增大,c(OH-)减小 | B. | $\frac{c(C{{O}_{3}}^{2-})}{c(HC{{O}_{3}}^{-})}$比值不断增大 | ||
| C. | c(CO32-)+c(HCO3-)+c(H2CO3)=0.10 | D. | c(OH-)-c(HCO3-)-c(H2CO3)=10-11.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ③④ | C. | ②③ | D. | ①② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com