
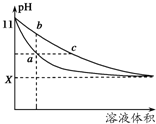
 某温度下,相同体积、相同pH的氨水和氢氧化钠溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )
某温度下,相同体积、相同pH的氨水和氢氧化钠溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )| A、a点导电能力比b点强 |
| B、对于b、c两点,Kb>Kc |
| C、与盐酸完全反应时,消耗盐酸体积Va>Vc |
| D、X的值接近7,但大于7 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、正极反应为:Zn-2e-=Zn2+ |
| B、一段时间后铜片增重,盐桥中K+移向CuSO4溶液 |
| C、电子从铜片经导线流向锌片 |
| D、电池工作时Zn2+和Cu2+的浓度保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=0的溶液中:Na+、[Al(OH)4]-、K+、NH4+ |
| B、由水电离出的c(H+)=10-12mol?L-1的溶液中:C1-、HCO3-、NH4+、SO32- |
| C、加入铝能离出H2的溶液中:Mg2+、NH4+、Cl-、SO42- |
| D、滴加石蕊试液显蓝色的溶液:K+、Ba2+、NO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、恒温时,向水中加入少量固体硫酸氢钠,c(H+)增大,水的离子积常数Kw不变 |
| B、0.1mol/LCH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| C、对于N2(g)+3H2(g)=2NH3(g),其他条件不变,充入N2,正反应速率增大,逆反应速率减小 |
| D、在硫酸钡悬浊液中加入足量饱和Na2CO3溶液,振荡、过滤、洗涤,沉淀中加入盐酸有气体产生,说明Ksp(BaSO4)>Ksp(BaCO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AgCl不溶于水,不能转化为AgI | ||||
| B、在含浓度均为0.001mol?L-1的Cl-、I-的溶液中缓慢滴AgNO3稀溶液,先析出AgI | ||||
| C、AgI比AgCl更难溶于水,所以AgCl可转化为AgI | ||||
D、常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol Cl2与水反应转移的电子数为NA |
| B、标准状况下,11.2L CCl4含有的分子数约为0.5NA |
| C、常温常压下,32g O2和O3的混合物中含有原子数为2NA |
| D、1L 0.1mol?L-1 Al2(SO4)3溶液中Al3+的数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含NA个氧分子的氧气的体积等于22.4L |
| B、Na2O2与H2O反应制O2,每生成1 mol O2转移4NA个电子 |
| C、1mol CH3OH在燃料电池负极发生反应时得到4NA个电子 |
| D、O.O1mol Mg在空气中完全燃烧,生成MgO和Mg3N2,转移电子数是0.02NA |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 1 |
| 2 |
| c(H2) |
| c(CH3OH) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com