
| A、某无色溶液滴入紫色石蕊试液显红色,该溶液一定显碱性 |
| B、验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含Cl- |
| C、某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐 |
| D、某溶液中滴加BaCl2溶液,生成白色沉淀,证明一定含有SO42- |


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
| 物质 | X | Y | Z |
| 初始浓度/mol?L-1 | 0.1 | 0.3 | 0 |
| 2min末浓度/mol?L-1 | 0.08 | ||
| 平衡浓度/mol?L-1 | 0.1 |
| A、0~2min的平均速率v(X)=0.01mol?L-1?min-1 |
| B、达平衡时Y的转化率为50% |
| C、其它条件不变,升高温度,平衡逆向移动 |
| D、其它条件不变,增加X的浓度,v正增大v逆减小,平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、配平后的化学方程式为Fe3O4+10HNO3(稀)═3Fe(NO3)3+NO↑+5H2O |
| B、反应中每还原0.4 mol氧化剂,就有1.2 mol电子转移 |
| C、稀HNO3在反应中只表现氧化性 |
| D、磁性氧化铁中的所有铁元素全部被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物 |
| B、Na2O与CO2发生化合反应生成Na2CO3,Na2O2与CO2发生置换反应生成O2 |
| C、Na2O有强还原性,Na2O2有强氧化性 |
| D、Na2O2可作供氧剂,而Na2O不能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应后溶液质量一定增加 |
| B、该金属可能是铁 |
| C、R的活泼性比Ag弱 |
| D、R表面有固体析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
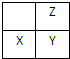 短周期元素X、Y、Z在周期表中的位置如图所示.下列说法正确的是( )
短周期元素X、Y、Z在周期表中的位置如图所示.下列说法正确的是( )| A、若它们都为金属元素,则X的氧化物中只含离子键 |
| B、他们原子的最外层电子数的大小顺序一定是Z=Y>X |
| C、若它们存在X2-、Y-、Z-离子,则离子半径大小为Y->X2->Z- |
| D、Z元素的最高正化合价不一定大于X元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
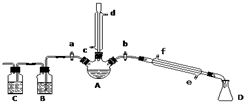 某兴趣小组在实验室用加热乙醇、浓H2SO4、溴化钠和少量水的混合物来制备溴乙烷,并检验反应的部分副产物.设计了如图装置,其中夹持仪器、加热仪器及冷却水管没有画出.请根据实验步骤回答:
某兴趣小组在实验室用加热乙醇、浓H2SO4、溴化钠和少量水的混合物来制备溴乙烷,并检验反应的部分副产物.设计了如图装置,其中夹持仪器、加热仪器及冷却水管没有画出.请根据实验步骤回答:查看答案和解析>>
科目:高中化学 来源: 题型:
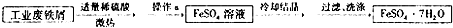
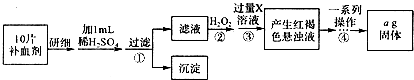
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com