
| A. | 乙酸和乙酸乙酯可用Na2CO3溶液加以区别. | |
| B. | 戊烷(C5H12)有两种同分异构体 | |
| C. | 乙烯、聚乙烯分子中均含有碳碳双键 | |
| D. | 二氯甲烷有两种同分异构体 |
分析 A.乙酸与碳酸钠反应生成气体,乙酸乙酯与碳酸钠溶液分层;
B.戊烷(C5H12)存在正、新、异戊烷;
C.聚乙烯不含碳碳双键;
D.甲烷为正四面体结构,4个H的位置相同.
解答 解:A.乙酸与碳酸钠反应生成气体,乙酸乙酯与碳酸钠溶液分层,现象不同,可鉴别,故A正确;
B.戊烷(C5H12)存在正、新、异戊烷,有3种同分异构体,故B错误;
C.聚乙烯不含碳碳双键,而乙烯含碳碳双键,故C错误;
D.甲烷为正四面体结构,4个H的位置相同,则二氯甲烷不存在同分异构体,故D错误;
故选A.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机反应为解答的关键,侧重分析与应用能力的考查,注意选项D为解答的易错点,题目难度不大.


 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:选择题
| A. | 醋酸除去水垢中的CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| B. | 碘水中通入足量的SO2:I2+SO2+2H2O=2I-+SO42-+4H+ | |
| C. | NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| D. | 惰性电极电解MgCl2溶液:Cl-+2H2O=2OH-+H2↑+Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 离子 | 物质的量浓度 |
| NH4+ | 0.4mol•L-1 |
| CO32- | 0.2mol•L-1 |
| SO42- | 0.1mol•L-1 |
| K+ | -≥0.2mol/l |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、CO2、CO、NO2都是酸性氧化物 | |
| B. | Na2O、Na2O2、Fe2O3、CuO都是碱性氧化物 | |
| C. | HCI、HClO、HClO3、HClO4都是强酸 | |
| D. | NaOH、KOH、Ba(OH)2都是强碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 科学家研制出多种新型杀虫剂代替DDT,化合物A是其中的一种,其结构如图.下列关于A的说法正确的是( )
科学家研制出多种新型杀虫剂代替DDT,化合物A是其中的一种,其结构如图.下列关于A的说法正确的是( )| A. | 化合物A的分子式为C15H22O3 | |
| B. | 与FeCl3溶液发生反应后溶液显紫色 | |
| C. | 1 mol A最多可以与2 mol Cu(OH)2反应 | |
| D. | 1 mol A最多与1 mol H2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定没有甲烷 | B. | 一定没有乙烷 | ||
| C. | 可能是甲烷和乙烷的混合物 | D. | 可能是乙烷和丙烷的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
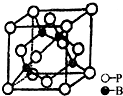 磷是生物体中不可缺少的元素之一,它能形成多种化合物.
磷是生物体中不可缺少的元素之一,它能形成多种化合物.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com