
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水 |
| B | 17.9 | 290 | 1.26 |
分析 (1)由表格数据可知,二者互溶,但沸点不同;
(2)电解质必须为化合物,且在熔化或溶于水可发生电离;NaHCO3为弱酸的酸式盐,为强电解质,完全电离生成钠离子和碳酸氢根离子;
(3)①中I元素的化合价升高,HI为还原剂,②中S元素的化合价升高,H2SO3为还原剂,结合还原剂的还原性大于还原产物的还原性分析;
(4)由电荷守恒可知,n=1,XO3-中正负化合价的代数和为-1.
解答 解:(1)由表格数据可知,二者互溶,但沸点不同,则将A和B相互分离的常用方法是蒸馏,故答案为:蒸馏;
(2)电解质必须为化合物,且在熔化或溶于水可发生电离,则属于电解质的为②③⑤⑦⑩;NaHCO3为弱酸的酸式盐,为强电解质,完全电离生成钠离子和碳酸氢根离子,电离方程式为NaHCO3═Na++HCO3-,故答案为:②③⑤⑦⑩;NaHCO3═Na++HCO3-;
(3)①中I元素的化合价升高,HI为还原剂,②中S元素的化合价升高,H2SO3为还原剂,由还原剂的还原性大于还原产物的还原性可知,HI、FeCl2、H2SO3 三种物质的还原性由强到弱的顺序为H2SO3>HI>FeCl2,故答案为:H2SO3>HI>FeCl2;
(4)由电荷守恒可知,n=1,XO3-中正负化合价的代数和为-1,设X元素的化合价为x,则x+(-2)×3=-1,解得x=+5,故答案为:+5;1.
点评 本题考查氧化还原反应,为高频考点,把握物质的性质、电解质的判断、氧化还原反应为解答的关键,侧重分析与应用能力的考查,注意还原性的比较方法,综合性较强,题目难度不大.


 教学练新同步练习系列答案
教学练新同步练习系列答案科目:高中化学 来源: 题型:选择题
| A. | a% | B. | 2a% | C. | 100%-1.75a% | D. | 100%-0.75a% |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上第一次学段考试化学卷(解析版) 题型:选择题
黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为
S(s)+2KNO3(s)+3C(s)═K2S(s)+N2(g)+3CO2(g)△H=xkJ•mol-1
已知:碳的燃烧热△H1=akJ•mol-1
S(s)+2K(s)═K2S(s)△H2=bkJ•mol-1
2K(s)+N2(g)+3O2(g)═2KNO3(s)△H3=ckJ•mol-1则x为
A.3a+b-c B.c-3a-b C.a+b-c D.c-a-b
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:选择题
0.1mol/LNa2CO3与0.1mol/LNaHCO3溶液的pH相比较(相同温度下)( )
A.前者大 B.相等 C.后者大 D.不能肯定
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,消耗NaOH溶液的体积(mL) | 待测盐酸溶液的体积(mL) |
| 1 | 0.10 | 20.02 | 20.00 |
| 2 | 0.10 | 20.00 | 20.00 |
| 3 | 0.10 | 19.98 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤⑦ | B. | ③④⑥ | C. | ②④⑤ | D. | ②③⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
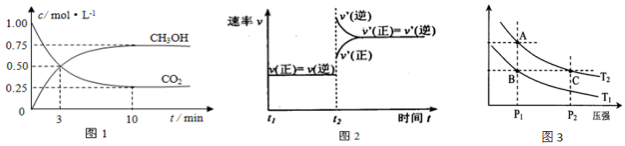
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
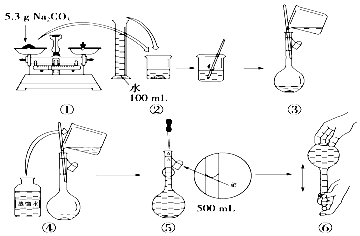
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
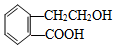 ,它可通过不同化学反应分别制得B、C、D和E四种物质.
,它可通过不同化学反应分别制得B、C、D和E四种物质.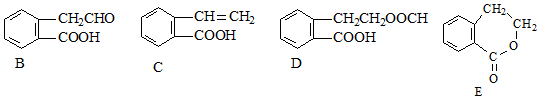
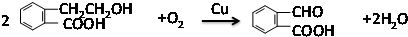 ,反应类型:氧化反应
,反应类型:氧化反应 ,反应类型:酯化反应
,反应类型:酯化反应 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com