
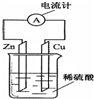
 如图是铜锌原电池的装置示意图.回答下列问题:
如图是铜锌原电池的装置示意图.回答下列问题:分析 在原电池中较活泼的金属作负极,失电子发生氧化反应,电子经导线传递到正极,溶液中阳离子移向正极,阴离子移向负极.Zn比Cu活泼,Zn做负极电极反应式为:Zn-2e-=Zn2+,在闭合回路中,电子的定向移动或离子的定向移动能形成电流,由此分析解答.
解答 解:(1)原电池是将化学能转化为电能的装置,故答案为:化学;电;
(2)在导线中电子流动的方向是从负极流向正极(或从锌片流向铜片);铜片为正极,铜片上氢离子放电产生气泡,故答案为:从负极流向正极(或从锌片流向铜片);铜片;铜片上有气泡冒出;
(3)原电池中,外电路中,负极上失电子发生氧化反应,正极上得电子发生还原反应,电子从负极沿导线流向正极;内电路中,电解质溶液中的阴离子向负极移动,阳离子向正极移动,所以形成了闭合回路,产生了电流,所以电极上进行的氧化还原反应中发生了电子的转移是原电池产生电流的本质原因.
故选c.
点评 本题考查了原电池产生电流的本质原因,难度不大,明确只有在闭合回路中才可能产生电流.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
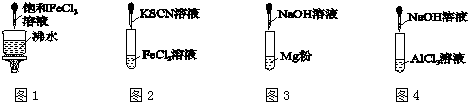
| A. | 图1产生红褐色沉淀 | |
| B. | 图2溶液颜色变红 | |
| C. | 图3放出大量气体 | |
| D. | 图4先出现白色胶状沉淀,后沉淀溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
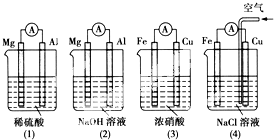
| A. | (1)(2)中活泼的Mg均作负极 | |
| B. | (2)中Mg作正极,电极反应式为6H2O+6e-=6OH-+3H2↑ | |
| C. | (3)中Fe作负极,电极反应式为Fe-2e-=Fe2+ | |
| D. | (4)中Cu作正极,电极反应式为2H++2e-=H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com