
������Ҫ�Ļ���ԭ�ϡ�ij̽��С���������з�Ӧ��ȡˮ���£�N2H4��H2O����
 CO(NH2)2+ 2NaOH + NaClO = Na2CO3 + N2H4��H2O + NaCl
CO(NH2)2+ 2NaOH + NaClO = Na2CO3 + N2H4��H2O + NaCl
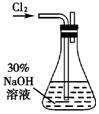
ʵ��һ�� �Ʊ�NaClO��Һ����ʵ��װ������ͼ��ʾ��
��1������30%NaOH��Һʱ�����貣����������Ͳ��� �����ţ���
A������ƿ B���ձ� C����ƿ D��������
��2�� ��ƿ�з�����Ӧ�Ļ�ѧ����ʽ�� ��
 ��3�� �����ʵ����Ҫ���������к͵ζ�ԭ���ⶨ��Ӧ����ƿ�л����Һ��NaOH��Ũ�ȡ���ѡ�����ṩ���Լ�(H2O2��Һ��FeCl2��Һ��0.1000mol��L-1���ᡢ��̪��Һ)�����ʵ�鷽����
��3�� �����ʵ����Ҫ���������к͵ζ�ԭ���ⶨ��Ӧ����ƿ�л����Һ��NaOH��Ũ�ȡ���ѡ�����ṩ���Լ�(H2O2��Һ��FeCl2��Һ��0.1000mol��L-1���ᡢ��̪��Һ)�����ʵ�鷽����
��
ʵ����� ��ȡˮ���¡���ʵ��װ������ͼ��ʾ��
���Ʒ�Ӧ�¶ȣ�����Һ©������Һ��������������ƿ�У���ַ�Ӧ��
��������������ƿ�ڵ���Һ���ռ�108~114����֡�
����֪��N2H4��H2O + 2NaClO �� N2�� + 3H2O + 2NaCl��
��4����Һ©���е���Һ�� �����ţ���
A��CO (NH2) 2��Һ B��NaOH��NaClO�����Һ
ѡ��������� ��
ʵ������ �ⶨ������º�����
��ȡ���5.000g����������NaHCO3���壬��ˮ���250mL��Һ���Ƴ�25.00mL����0.1000mol��L-1��I2��Һ�ζ����ζ������У���Һ��pH������6.5���ҡ�
����֪��N2H4��H2O + 2I2 = N2��+ 4HI + H2O��
��5���ζ������У�NaHCO3�ܿ�����Һ��pH��6.5���ң�ԭ���� ��
��6��ʵ��������I2��Һ��ƽ��ֵΪ18.00mL�������ˮ���£�N2H4��H2O������������Ϊ ��
��֪ʶ�㡿�л�ѧʵ�鷽�����������
���𰸽����� ��1�� B��D ��2�� Cl2+ 2NaOH �� NaClO + NaCl + H2O
��3�� ȡһ������ƿ�ڻ����Һ������������H2O2��Һ�μ�2~3�η�̪��Һ���� 0.100mol��L-1����ζ����ظ���������2~3��
��4�� B �������������Һװ����ƿ�У���Ӧ���ɵ�ˮ���»ᱻ������������
��5�� NaHCO3����ζ������в�����HI��Ӧ ��6�� 9%
��������1��������Һ��Ҫ���ձ��ڽ��У���Ҫ����Ͳ��ȡˮ���ò��������裬���õ���ͷ�ιܣ�����ѡ��BD����2��Cl2��NaOH��Һ������Ӧʱ�������Ȼ��ơ��������ƺ�ˮ�����Է�Ӧ�����������������ƣ����������Ȼ��ơ��������ƺ�ˮ���ù۲취��ƽ���ɣ����Է���ʽ�ǣ�Cl2+2NaOH=NaCl+NaClO+H2O����3��ȡһ������ƿ�ڻ����Һ������������H2O2��Һ��˫��ˮ��Ŀ���dz�ȥ��Һ�еĴ���������ӣ����μ�2~3�η�̪��Һ���� 0.100mol��L-1����ζ����ظ���������2~3�� ����4����Һ©���е���Һ��NaOH��NaClO�����Һ����Ϊ�������������Һװ����ƿ�У���Ӧ���ɵ�ˮ���»ᱻ����������������5��NaHCO3����ζ������в�����HI��Ӧ�����Կ��Կ�����Һ��pHֵ����6�����ݷ���ʽI2 �����ʵ�����0.1x18x10-3=1.8x10-3mol��ˮ���µ����ʵ�����0.9x10-3mol��������Ϊ0.045g��Ϊֻȡ����ԭ��Һ��ʮ��֮һ��������������Ϊ =9%
=9%
��˼·�㲦�����⿼��ʵ�鷽������������ۣ�����ʵ��������ѡ�ζ�ʵ���еij��ӣ������⣬����ѧ���ۺϷ����������������ȡ��Ϣ�������ȷ��棬�Ѷ��еȡ�


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�ö��Ե缫���һ����������ͭ��Һ���������е�ʵ����������ͼ��ʾ���������ʾת�Ƶ��ӵ����ʵ������������ʾ�������в�����������������״�����������ж���ȷ���� ( )
��A���������У���Һ��pH��������
��B����ת��0.4mol e��ʱ��������ɵ�ͭΪ6.4g��
��C�������缫��ӦʽΪ2H2O + 4e��=4H++O2��
��D��Q���Ӧ�������У�H2��O2�������Ϊ2:1

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���۲컷��ϩ( )�Ƿ���ʹ����KMnO4��Һ��ɫ���Ƚ�����ϩ�����ʵ����ܼ�������������0.005mol��L-1 KMnO4��Һ��������������һ���Լ����ʺ������ܽ��ϩ����ʵ�飨 ����
)�Ƿ���ʹ����KMnO4��Һ��ɫ���Ƚ�����ϩ�����ʵ����ܼ�������������0.005mol��L-1 KMnO4��Һ��������������һ���Լ����ʺ������ܽ��ϩ����ʵ�飨 ����
A�����Ȼ�̼ B���ѻ����� C���ױ� D��ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪һ��̼ԭ����������OH�Ľṹ���ȶ�����ܿ���ȥһ����ˮ����仯���£�
 ��
��  + H2O
+ H2O
��ͼ��B��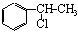 ��
��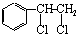 �ȶ���A��Cl2������Ӧ���ɵIJ��E��һ�ָ߷��ӻ���������ܺã�������һЩ������ǡ�������һЩС���Ӷ��Ѿ���ȥ��
�ȶ���A��Cl2������Ӧ���ɵIJ��E��һ�ָ߷��ӻ���������ܺã�������һЩ������ǡ�������һЩС���Ӷ��Ѿ���ȥ��
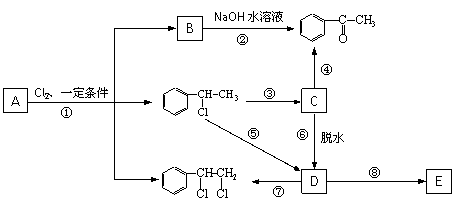 |
��1��A�Ļ�ѧ����Ϊ___ _
��2���ڢܲ��Ļ�ѧ����ʽΪ__________���÷�Ӧ����Ϊ_____��
��3���ڢ߲��Ļ�ѧ����ʽΪ__________���÷�Ӧ����Ϊ_____��
��4��E�Ľṹ��ʽΪ______��
��5����������������������������ȡ�����ұ�����ֻ�����ֲ�ͬ��ѧ���������C��ͬ���칹��Ľṹ��ʽ�ֱ��� �� �� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��һ�������£���PCl3(g)��Cl2(g)������������2L�ܱ������з���������Ӧ��PCl3(g) ��Cl2(g)  PCl5(g)��5minĩ�ﵽƽ�⣬�й��������±���
PCl5(g)��5minĩ�ﵽƽ�⣬�й��������±���
| PCl3(g) | Cl2(g) | PCl5(g) | |
| ��ʼŨ�ȣ�mol•L��1�� | 2.0 | 1.0 | 0 |
| ƽ��Ũ�ȣ�mol•L��1�� | C1 | C2 | 0.4 |
�����жϲ���ȷ����
A���������¶ȣ���Ӧ��ƽ�ⳣ����С��������ӦΪ����
B����Ӧ5min�ڣ�v(PCl3)=0.08 mol•L-1•min-1
C����������Cl2Ϊ1.2molʱ�����淴Ӧ�ﵽƽ��״̬
D��ƽ�������2.0mol PCl3��1.0mol Cl2������ͬ�������ٴ�ƽ��ʱ��c(PCl5)<0.2 mol•L-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������0.5g H2��11g CO��4g O2��ɵĻ�����壬�����ԼΪ��������
| �� | A�� | 8.4 L | B�� | 11.2 L | C�� | 14.0 L | D�� | 16.8 L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����й����ʷ������ɲ���ȷ����
�ٵ���ʣ������������ᡢ�Ȼ��������� �ڻ����BaCl2��Ca��OH��2��HNO3��HT
�ۻ������ᡢƯ�ۡ�ˮ������ˮ�� ��ͬ�������壺���ʯ��ʯī��C60��C70
A���٢� B���ڢ� C���ۢ� D���ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���淴ӦN2��3H22NH3�ǹ�ҵ�Ϻϳɰ�����Ҫ��Ӧ��

(1)����ͼ1��д���ϳɰ����Ȼ�ѧ�� ��ʽ__________________________________(������E1��E2��E3��ʾ)��
��ʽ__________________________________(������E1��E2��E3��ʾ)��
(2)ͼ1�����߲�����ͨ���ı仯ѧ��Ӧ�е�________�������������ĸı���ͼ2����һʱ�������ĸı���ͬ________(�á�t1��t6����ʾ)��
(3)t3ʱ�̸ı��������____________�� t5ʱ�̸ı��������____________��
t5ʱ�̸ı��������____________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com