
(1)98%的浓硫酸的物质的量浓度是_______________mol·L-1。
(2)露置若干时间后的硫酸的物质的量浓度是_______________mol·L-1。
(3)硫酸浓度发生变化的原因是____________________________________________________。
(4)若分别用下列方法鉴别浓硫酸和稀硫酸,可以达到目的的是________________________。
A.常温下加入铜片
B.常温下加入铁片
C.常温下加入木炭
D.用玻璃棒各蘸取一滴涂在纸上
E.分别滴到CuSO4·5H2O上
F.分别加入到盛有少量水的小烧杯中
科目:高中化学 来源:高中化学习题 题型:058
实验室可用NaBr、浓硫酸、乙醇为原料制备溴乙
烷,已知反应物的用量:0.3molNaBr(s);0.25mol
C2H5OH(乙醇);36mL浓硫酸(溶质分数为98%,密
度1.84g/cm3);25mLH2O,其中乙醇的密度为
0.80g/cm3,回答下列问题:
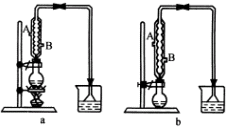
(1)该实验应选择图中的a还是b装置?__________
(2)反应装置中的烧瓶应选择下列哪种规格最合适?
[ ]
|
A.50mL |
B.100mL |
|
C.150mL |
D.250mL |
(3)冷凝管中的冷凝水的流向应是________
|
A.A进B出 |
B.B进A出 |
|
C.从A进或B进均可 |
(4)由NaBr、浓硫酸和乙醇共热制备C2H5Br反应的化学方程式为________;
可能发生的副反应为:________。
(5)上述反应完成后,需要将烧瓶中的有机物蒸馏出来,所得馏出液中含有________。
(6)从棕黄色的粗溴乙烷制取无色的溴乙烷应加入的试剂是________,必须使用的仪器是________。
(7)本实验的产率为60%,则可制取溴乙烷________g。
(8)为除去溴乙烷中残留的少量水,可选用无水CaCl2作干燥剂,并蒸馏。为证明最终得到的产品一溴乙烷中含有溴元素,可采取的实验方法是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com