
| A. | 在分子组成上相差一个或若干个CH2原子团的物质一定互称为同系物 | |
| B. | 具有同分异构现象的有机化合物互称为同分异构体 | |
| C. | 同素异形体是指同种元素形成不同的单质 | |
| D. | 含有相同的质子数而不同的中子数的同一类元素的原子互称为同位素 |
分析 A.结构相似,分子组成上相差一个或若干个CH2原子团的物质,互为同系物;
B.分子式相同结构不同的有机物互为同分异构体;
C.同素异形体是同种元素组成的不同单质;
D.同位素是质子数相同而中子数不同的同种元素原子之间互称;
解答 解:A.同系物必然属于同一类物质,分子式符合CnH2n的有机物存在烯烃和环烷烃的同分异构现象,因此C3H6和C5H10不一定是同系物,故A错误;
B.分子式相同结构不同的有机物具有同分异构现象,有机化合物互称为同分异构体,故B正确;
C.同素异形体是同种元素组成的不同单质,如O2、O3,故C正确;
D.同位素是质子数相同而中子数不同的同种元素的不同原子之间互称,如氢元素的同位素有H、D、T,故D正确;
故选A.
点评 本题考查了同素异形体、同位素、同分异构体同系物等概念实质的理解应用,掌握概念实质是解题关键,题目难度不大.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:解答题
 2015年8月12号接近午夜时分,天津滨海新区一处集装箱码头发生爆炸.发生爆炸的是集装箱内的易燃易爆物品,爆炸火光震天,并产生巨大蘑菇云.根据掌握的信息分析,装箱区的危险化学品可能有钾、钠、氯酸钠、硝酸钾、烧碱,硫化碱、硅化钙、三氯乙烯、氯碘酸等.运抵区的危险化学品可能有环己胺、二甲基二硫、甲酸、硝酸铵、氰化钠、4,6-二硝基苯-邻仲丁基苯酚等.
2015年8月12号接近午夜时分,天津滨海新区一处集装箱码头发生爆炸.发生爆炸的是集装箱内的易燃易爆物品,爆炸火光震天,并产生巨大蘑菇云.根据掌握的信息分析,装箱区的危险化学品可能有钾、钠、氯酸钠、硝酸钾、烧碱,硫化碱、硅化钙、三氯乙烯、氯碘酸等.运抵区的危险化学品可能有环己胺、二甲基二硫、甲酸、硝酸铵、氰化钠、4,6-二硝基苯-邻仲丁基苯酚等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠和冷水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 金属铝溶于氢氧化钠溶液中:Al+2OH-═Al${O}_{2}^{-}$+H2↑ | |
| C. | 金属铝溶于盐酸中:2Al+6H+═2Al3++3H2↑ | |
| D. | Fe(OH)3跟盐酸反应:OH-+H+═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的摩尔质量为44g | |
| B. | 1 mol N2的质量是14g | |
| C. | 标准状况下,1 mol CO2所占的体积约是22.4L | |
| D. | 将40 g NaOH溶于1 L水中,所得溶液中NaOH的物质的量浓度为1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
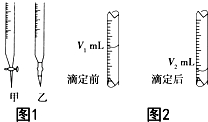 现用物质的量浓度为a mol•L-1的标准NaOH溶液去滴定V mL盐酸的物质的量浓度,请填写下列空白:
现用物质的量浓度为a mol•L-1的标准NaOH溶液去滴定V mL盐酸的物质的量浓度,请填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
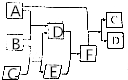 有A、B、C、D、E、F六种微粒,其中A~E五种微粒均由两种元素组成且均含10个电子,它们有如图所示的转化关系:
有A、B、C、D、E、F六种微粒,其中A~E五种微粒均由两种元素组成且均含10个电子,它们有如图所示的转化关系:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com