
1判断正误,正确的划“√”,错误的划“×”
(1)CH3COOH溶液加水稀释后,溶液中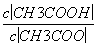 的值减小( )
的值减小( )
(2013·江苏,11C)
(2)室温下,对于0.10 mol·L-1的氨水,加水稀释后,溶液中c(NH )·c(OH-)变大( )
)·c(OH-)变大( )
(2013·福建理综,8B)
(3)25 ℃时,用醋酸溶液滴定等浓度NaOH溶液至pH=7,V醋酸<VNaOH( )
(2013·重庆理综,2B)
(4)稀醋酸加水稀释,醋酸的电离程度增大,溶液的pH减小( )
(2012·重庆理综,10B)
(5)中和等体积、等物质的量浓度的盐酸和醋酸所消耗的n(NaOH)相等( )
(2012·福建理综,10C)
 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应:X(g)+Y(g)2Z(g) ΔH<0。一段时间后达到平衡,反应过程中测定的数据如下表:
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是( )
A.反应前2 min的平均速率v(Z)=2.0×10-3mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前v逆>v正
C.保持其他条件不变,起始时向容器中充入0.32 mol气体X和0.32 mol气体Y,到达平衡时,n(Z)<0.24 mol
D.其他条件不变,向平衡体系中再充入0.16 mol气体X,与原平衡相比,达到新平衡时,气体Y的转化率增大,X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一般在飞船内安装盛有Na2O2或K2O2颗粒的装置,它的用途是产生氧气。下列关于Na2O2的叙述正确的是 ( )。
A.Na2O2中阴、阳离子的个数比为1∶1
B.Na2O2分别与水及CO2反应产生相同量的O2时,需要水和CO2的质量相等
C.Na2O2分别与水及CO2反应产生相同量的O2时,转移电子的物质的量相等
D.Na2O2的漂白原理与SO2的漂白原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
在Na2CO3中加醋酸产生CO2气体,试从电离平衡常数的角度解释原因[已知:K(CH3COOH)=1.7×10-5;K(H2CO3)=4.3×10-7。]:__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(2)相同体积、相同pH值的盐酸和醋酸
①加入足量的Zn,在丙图中画出H2体积的变化图像

单位时间内,________产生的H2多,反应停止时,______产生的H2多。
查看答案和解析>>
科目:高中化学 来源: 题型:
运用电离常数判断可以发生的反应是( )
| 酸 | 电离常数(25 ℃) |
| 碳酸 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
| 次溴酸 | Ki=2.4×10-9 |
①HBrO+Na2CO3===NaBrO+NaHCO3
②2HBrO+Na2CO3===2NaBrO+H2O+CO2↑
③HBrO+NaHCO3===NaBrO+H2O+CO2↑
④NaBrO+CO2+H2O===NaHCO3+HBrO
A.①③ B.②④
C.①④ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验方案合理的是( )。
A.用通入酸性高锰酸钾溶液的方法除去乙烯中混有的二氧化硫
B.用加入浓溴水的方法分离苯和苯酚的混合物
C.用灼热的铜丝网除去N2中混有的少量O2
D.用燃烧的方法除去CO2中混有的少量CO
查看答案和解析>>
科目:高中化学 来源: 题型:
已知常温下在溶液中可发生如下两个离子反应:
Ce4++Fe2+===Fe3++Ce3+
Sn2++2Fe3+===2Fe2++Sn4+
由此可以确定Fe2+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序是( )
A.Sn2+、Fe2+、Ce3+ B.Sn2+、Ce3+、Fe2+
C.Ce3+、Fe2+、Sn2+ D.Fe2+、Sn2+、Ce3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com