
实验室中模拟纯碱工业制法,进行了如下三步实验:①将CO2、NH3通入H2O中制得NH4HCO3,②NH4HCO3和饱和食盐水反应生成小苏打,③将小苏打制成纯碱。
(1)步骤①先通入水中的气体是______。析出NH4HCO3的反应有两步,第二步反应的离子方程式为____________________。
(2)步骤②生成了含少量NaCl的小苏打,现用滴定法测定其中NaHCO3的含量。过程为:称取一定质量样品,配成250mL溶液,取出25.00mL用0.1000mol/L的盐酸滴定。实验中所写的定量仪器除滴定管外,还有_______、_______。所用的指示剂是______________。
(3)步骤②生成了含少量NaHCO3的纯碱。若用重量法(限用试剂:稀盐酸)测定其中Na2CO3含量,请设计实验方案:_______________________。若该样肠中NaHCO3含量的准确值为99.5%,而上述实验结果为97.6%,则测定的相等误差为___________,可能造成该实验误差的原因是________________。
科目:高中化学 来源:2017届湖北省八校高三第二次联考(3月)理综化学试卷(解析版) 题型:选择题
下列各组澄清溶液中离子能大量共存,且加入(或滴入)X试剂后发生反应的离子方程式书写正确的是( )
选项 | 离子组 | X试剂 | 离子方程式 |
A | K+、Na+、ClO-、SO42- | 少量SO2 | SO2+ClO-+H2O=SO42-+Cl-+2H+ |
B | NH4+、Fe3+、Br-、SO42- | 过量H2S | 2Fe3++H2S=2Fe2++S↓+2H+ |
C | NH4+、Na+、Fe3+、AlO2- | 过量铜粉 | 2Fe3++Cu=2Fe2++Cu2+ |
D | K+、Na+、 HCO3-、AlO2- | 少量HCl | H++AlO2-+H2O=Al(OH)3↓ |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省牡丹江市高一3月月考化学试卷(解析版) 题型:选择题
已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
A. 原子半径:A>B>D>C B. 原子序数:d>c>b>a
C. 离子半径:C3->D->B+>A2+ D. 单质还原性:A>B>D>C
查看答案和解析>>
科目:高中化学 来源:2017届吉林省高三第五次摸底考试理综化学试卷(解析版) 题型:简答题
铬同铁、钴、镍、铜等金属形成的合金,用于航空、宇航、电器、仪表及高端科技领域。
(1)铬的基态原子的价电子层排布式是__________________;
(2)氯化铬酰(CrO2Cl2)的熔点为-96.5℃,沸点为117℃,固态氯化铬酰属于_______晶体。制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl+2CrO2Cl2+3COCl2↑,COCl2分子中σ键和π键的个数比为_____,空间构型为_______;CCl4的中心原子杂化类型为________,其等电子体为___________(写出一个离子形式);
(3)某镍配合物结构如下图所示。
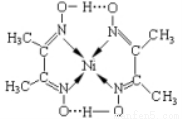
分子内含有的作用力有_________________(填序号),其中属于第二周期元素的第一电离能由大到小的顺序是_____________(填元素符号);
A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
(4)向CuSO4溶液中通入氨气得到深蓝色溶液的离子方程式为___________________;
(5)CoCl3·4NH3中心原子Co3+配位数为6,向含0.1 mol CoCl3·4NH3的溶液中滴加2 mol·L-1 AgNO3溶液,反应完全共消耗50 mL溶液,则该配合物的化学式为________________;
(6)下图是Fe的晶体一种堆积方式,若晶胞的边长为a pm,则晶体的密度为_______g·cm-3(用含a和NA的表达式表示)。
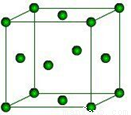
查看答案和解析>>
科目:高中化学 来源:2017届吉林省高三第五次摸底考试理综化学试卷(解析版) 题型:选择题
分子式为C4H8ClBr的有机物共有(不含立体异构)
A. 9种 B. 10种 C. 11种 D. 12种
查看答案和解析>>
科目:高中化学 来源:2017届上海市普陀区高三第二学期质量调研(二模)化学试卷(解析版) 题型:选择题
对化工生产认识正确的是
A. 海水提溴:一般需要经过浓缩、氧化、提取三个步骤
B. 合成氯化氢:通入H2的量略大于C12,可以使平衡正移
C. 合成氨:采用500℃的高温,有利于增大反应正向进行的程度
D. 侯德榜制碱法:析出NaHCO3的母液中加入消石灰,可以循环利用NH3
查看答案和解析>>
科目:高中化学 来源:2017届上海市普陀区高三第二学期质量调研(二模)化学试卷(解析版) 题型:选择题
有关漂白精的认识错误的是
A. 漂白精的主要成分是次氯酸钙 B. 漂白精露置在空气中会失效
C. 漂白精水溶液具有漂白性 D. 漂白精杀菌效果随pH降低而增强
查看答案和解析>>
科目:高中化学 来源:2017届山西省太原市高三模拟考试(一)理综化学试卷(解析版) 题型:选择题
利用如图所示装置进行下列实验,能得出相应实验结论的是( )
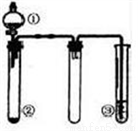
选项 | ① | ② | ③ | 实验结论 |
A | 稀盐酸 | CaCO3 | Na2SiO3溶液 | 非金属性:Cl>C>Si |
B | 浓硫酸 | 蔗糖 | Ba(NO3)2溶液 | 验证SO2与可溶性钡盐可生成白色沉淀 |
C | 浓氨水 | 生石灰 | 酚酞溶液 | 氨气的水溶液呈碱性 |
D | 浓硝酸 | Fe | NaOH溶液 | 铁和浓硝酸反应可生成NO2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:宁夏勤行校区2016-2017学年高二下学期第一次(3月)月考化学试卷 题型:简答题
现有部分元素的性质或原子结构信息如表,据此回答下列问题:
元素编号 | 元素性质或原子结构 |
T | M层上有2对成对电子 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物的水溶液显碱性 |
Z | 短周期元素最高正化合价是+7价 |
W | 3d能级电子数是最外层电子数的3倍 |
(1)元素X的基态原子核外共有________种空间运动状态不同的电子,元素X与H元素形成的化合物是当今重要的能源,该化合物的电子式为________。
(2)元素Y的价电子排布图为________________,元素Y与元素T相比,电负性较大的是________(用元素符号表示)。
(3)元素Z与元素T相比,非金属性强的是________(用元素符号表示),下列表述中能证明这一事实的是________。
a.常温下Z的单质和T的单质状态不同
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
b.Z的氢化物比T的氢化物稳定
d.最高价氧化物对应水化物的酸性Z的比T的酸性强
(4)W的价电子排布式为________,稳定性比较:W3+________W2+(填“>”或“<”),原因是__________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com