
| A.黄铁矿煅烧前需要粉碎,因为大块的黄铁矿不能在空气中反应 |
| B.从沸腾炉出来的炉气需净化,因为炉气中二氧化硫会与杂质反应 |
| C.二氧化硫氧化为三氧化硫时需使用催化剂,这样可以提高二氧化硫的转化率 |
| D.三氧化硫用98.3%的浓硫酸吸收,目的是防止形成酸雾,以提高三氧化硫的吸收效率 |
科目:高中化学 来源:不详 题型:实验题

| A.向装置中通入氮气且保持体积不变 |
| B.向装置中通入氧气且保持体积不变 |
| C.添加更多的催化剂 |
| D.降低温度,及时转移SO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
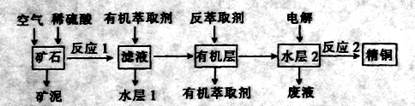
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
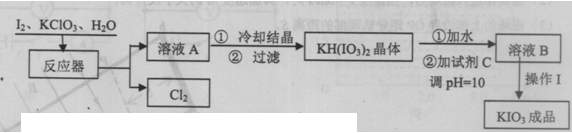
 2)生产过程中,在反应器中加入反应物之后,还需加入硝酸酸化并保持微沸1小时,加硝酸的目的是 。微沸1小时的目的是 。
2)生产过程中,在反应器中加入反应物之后,还需加入硝酸酸化并保持微沸1小时,加硝酸的目的是 。微沸1小时的目的是 。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com