
分析 I、若A是一种单质为淡黄色固体,应为S;B为酸雨的成因之一,且可使品红溶液褪色,应为SO2,则C为SO3,D为H2SO4;
Ⅱ、若A气体可使湿润的红色石蕊试纸变蓝,应为NH3,常温下D的浓溶液能使金属Fe、Al钝化,应为HNO3,则B为NO,C为NO2,结合对应物质的性质以及题目要求解得该题.
解答 解:I、若A是一种单质为淡黄色固体,应为S;B为酸雨的成因之一,且可使品红溶液褪色,应为SO2,则C为SO3,D为H2SO4,
(1)B为二氧化硫,具有还原性,可与高锰酸钾发生氧化还原反应,使高锰酸钾溶液褪色,
故答案为:溶液褪色;还原性;
(2)浓硫酸具有强氧化性,在加热条件下与铜发生氧化还原反应,反应的方程式为Cu+2H2SO4(浓)=SO2↑+CuSO4+2H2O,由方程式可知此反应中作氧化剂的D与参加反应的D的物质的量之比为1:2,
故答案为:Cu+2H2SO4(浓)=SO2↑+CuSO4+2H2O;1:2;
Ⅱ、若A气体可使湿润的红色石蕊试纸变蓝,应为NH3,常温下D的浓溶液能使金属Fe、Al钝化,应为HNO3,则B为NO,C为NO2,
(1)实验室用氯化铵和氢氧化钙在加热条件下反应生成氨气,反应的方程式为2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,C→D的离子方程式为3NO2+H2O=2H++2NO3-+NO↑,
故答案为:2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;3NO2+H2O=2H++2NO3-+NO↑;
(2)氨气在催化条件下与氧气反应生成NO,反应的方程式为4NH3+5O2 $\frac{\underline{\;\;催化剂\;\;}}{高温高压}$4NO+6H2O,
故答案为:4NH3+5O2 $\frac{\underline{\;\;催化剂\;\;}}{高温高压}$4NO+6H2O;
(3)碳酸钠溶液呈碱性,二氧化氮气体与碳酸钠溶液反应生成硝酸钠、亚硝酸钠以及二氧化碳气体,反应的方程式为,
故答案为:2NO2+Na2CO3═NaNO2+NaNO3+CO2↑.
点评 本题考查元素化合物的推断,为高考常见题型,侧重于学生的分析能力的考查,涉及S、N元素单质及其化合物性质与转化,难度中等,需要学生熟练掌握元素化合物知识,注意相关知识的归纳.


科目:高中化学 来源: 题型:选择题
| A. | Na+、Al3+、SO42-、HCO3- | B. | Na+、Ba2+、Cl-、SO42- | ||
| C. | Fe3+、Mg2+、SO42-、NO3- | D. | Cu2+、K+、NO3-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “雾霾天气”、“温室效应”、“光化学烟雾”的形成都与氮的氧化物无关 | |
| B. | 乙醇溶液、臭氧、双氧水、高锰酸钾溶液均可用于消毒杀菌,且原理不同 | |
| C. | 生石灰、铁粉、硅胶是食品包装中常用的干燥剂 | |
| D. | 纯碱是焙制糕点所用的发酵粉的主要成分之一,也可用纯碱除去物品表面的油污 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用广泛pH试纸测得 0.1mol/L NH4Cl溶液的pH=5.2 | |
| B. | 酸碱中和滴定时锥形瓶用蒸馏水洗涤后,再用待测液润洗后装液进行滴定 | |
| C. | 将碘水倒入分液漏斗,加入适量苯振荡后静置,从分液漏斗下口放出碘的苯溶液 | |
| D. | 常温常压下,将15g NO和8g O2混合,所得混合气体分子总数小于0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可使用填埋法处理未经分类的生活垃圾 | |
| B. | 光化学烟雾的形成与汽车尾气中的氮氧化物有关 | |
| C. | 光导纤维都是有机高分子化合物 | |
| D. | “鸟巢”使用钒氮合金钢,该合金熔点、硬度和强度均比纯铁高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO中混有CO2(NaOH溶液) | B. | H2中混有HCl(NaOH溶液) | ||
| C. | NO中混有NO2(水) | D. | CO2中混有HCl(饱和Na2CO3溶液) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
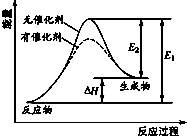
| A. | 该反应为放热反应 | |
| B. | 催化剂能降低该反应的焓变 | |
| C. | 催化剂能降低E2的值 | |
| D. | 逆反应的活化能大于正反应的活化能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 125 mL | B. | 275 mL | C. | 325 mL | D. | 450 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验现象 | 原因 |
| 溶液从初的紫色逐渐变为红色 | 氯气与水反应生成的H+使石蕊试液变色 |
| 随后溶液逐渐变为无色 | 氯气与水反应生成的HClO将石蕊氧化为无色物质 |
| 然后溶液从无色逐渐变为黄绿色 | 继续通入的氯气溶于水使溶液呈黄绿色 |
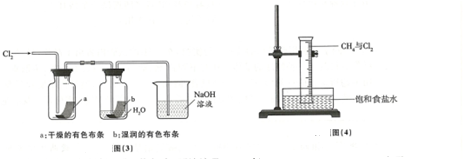
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com