
| A. | 含1molFeCl3的饱和溶液最多可形成胶体粒子数为NA | |
| B. | 1 ml的水分子与1 mol的氢氧根离子所含电子数均为10NA | |
| C. | 常温、常压下,4.6 g NO2和N2O4混合气体中含有的氧原子数目为0.2NA | |
| D. | 在高温下,有1 mol Fe与足量的水蒸气反应,转移电子的数目为3NA |
分析 A.氢氧化铁胶粒为氢氧化铁的聚集体;
B.1 ml的水分子的质量约为1g,根据n=$\frac{m}{M}$计算出水的物质的量及含有电子的物质的量;1mol氢氧根离子中含有10mol电子;
C. NO2和N2O4的最简式为NO2,根据最简式计算含有氧原子数;
D.高温下铁与水蒸气生成的是四氧化三铁,产物中Fe元素的化合价为$\frac{8}{3}$价.
解答 解:A.由于氢氧化铁胶粒为氢氧化铁的聚集体,则含1molFeCl3的饱和溶液最多可形成胶体粒子数小于NA,故A错误;
B.1 mol的氢氧根离子含有10mol电子,所含电子数均为10NA,而1 ml的水分子的质量为1g,其物质的量为:$\frac{1g}{18g/mol}$=$\frac{1}{18}$mol,含有电子的物质的量为:$\frac{1}{18}$mol×10=$\frac{5}{9}$mol,含有电子数为$\frac{5}{9}$NA,故B错误;
C.4.6 g NO2和N2O4混合气体中含有4.6g最简式NO2,含有最简式的物质的量为:$\frac{4.6g}{46g/mol}$=0.1mol,含有氧原子的物质的量为:0.1mol×2=0.2mol,则混合气体中含有的氧原子数目为0.2NA,故C正确;
D.在高温下,有1 mol Fe与足量的水蒸气反应生成四氧化三铁,转移电子的物质的量为:1mol×$\frac{8}{3}$=$\frac{8}{3}$mol,转移电子的数目为$\frac{8}{3}$NA,故D错误;
故选C.
点评 本题考查阿伏加德罗常数的有关计算与判断,题目难度中等,注意掌握以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确氢氧化铁胶粒的组成、铁与水蒸气的反应产物为解答关键,试题培养了学生的分析能力及化学计算能力.


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源:2016-2017学年江苏省徐州市高一上第一次月考化学卷(解析版) 题型:选择题
某溶液中可能含有下列6种离子中的某几种:Cl—、SO42— 、CO32—、NH4+、Na+、K+。为确认溶液组成进行如下实验:(1)200mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶。(2)向(1)的滤液中加入足量的NaOH溶液,加热,产生能促使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出)。由此可以得出关于原溶液组成的正确结论是
、CO32—、NH4+、Na+、K+。为确认溶液组成进行如下实验:(1)200mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶。(2)向(1)的滤液中加入足量的NaOH溶液,加热,产生能促使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出)。由此可以得出关于原溶液组成的正确结论是
A.一定存在SO42—、CO32—、NH4+,可能存在Cl—、Na+、K+
B.一定存在Cl—、SO42—、CO32—、NH4+,一定不存在Na+、K+
C.原溶液中c(CO32—)=0.01mol·L-1
D.如果上述6种离子都存在,则c(Cl—)>c(SO42—)
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 周期表中第15纵行(从左往右数)元素的最高正价为+5 | |
| B. | 元素周期表中位于金属和非金属非界线附近的元素属于过渡元素 | |
| C. | 离子化合物中可能含有共价键,共价化合物中可能含有离子键 | |
| D. | 同一主族的甲乙两种元素,甲的原子序数为a,则乙的原子序数可能为a+4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气是一种黄绿色有毒气体,密度比空气大 | |
| B. | 氯气常用于制备漂白粉等杀菌消毒剂 | |
| C. | 新制氯水具有漂白作用,是因为Cl2具有强氧化性 | |
| D. | 氯元素在自然界中以化合态存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由电子转移守恒和氯元素守恒可推出2b+a=6c | |
| B. | 若氯酸分解所得混合气体,在相同状态下密度是氢气的25.75信,则反应方程式可表示为:5HClO3=O2↑+Cl2↑+3HClO4+H2O | |
| C. | 由非金属性Cl>S,可推知酸性HClO4>H2SO4 | |
| D. | 若化学计量数a=3,b=2,则该反应转移电子数为10e- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
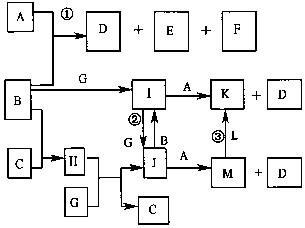 如图是部分元素的单质及其化合物的转化关系图(有关反应的条件己略去);己知:B、C、G、L 均为单质,其中在常温、常压下,G是固体,B、C、L是气体;生成物E具有漂白性,且焰色反应呈黄色;F 在常温下是液体;K、M 均为不溶于水的沉淀,其中K 为红褐色.
如图是部分元素的单质及其化合物的转化关系图(有关反应的条件己略去);己知:B、C、G、L 均为单质,其中在常温、常压下,G是固体,B、C、L是气体;生成物E具有漂白性,且焰色反应呈黄色;F 在常温下是液体;K、M 均为不溶于水的沉淀,其中K 为红褐色. ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4在水溶液的电离方程式 NaHSO4?Na++H++SO42- | |
| B. | 氯化铵在氘水中的水解离子方程式 NH4++D2O?NH3•HDO+D+ | |
| C. | NaHS在水中的水解离子方程式 HS-+H2O?S2-+H3O+ | |
| D. | 碳酸钾固体在水中的水解离子方程式CO32-+2H2O?2OH-+H2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳的结构式:O-C-O | |
| B. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| C. | F原子结构示意图: | |
| D. | N2的电子式: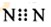 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上第一次月考化学试卷(解析版) 题型:选择题
在密闭容器中进行如下反应:X2(g)+Y2(g)  2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
A. Z为0.3mol/L B. Y2为0.4mol/L C. X2为0.2mol/L D. Z为0.4mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com