
【题目】利用下列实验探究亚硝酸钠(NaNO2)的化学性质。(AgNO2是淡黄色难溶于水的固体)
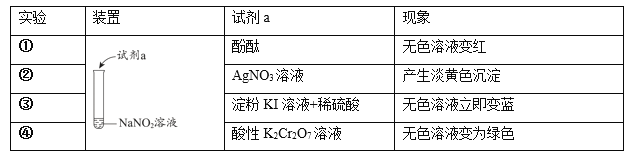
由上述实验所得结论不正确的是
A.NaNO2溶液呈碱性:NO2- +H2O![]() HNO2 +OH-
HNO2 +OH-
B.NaNO2可与某些盐发生复分解反应:NO2- + Ag+= AgNO2↓
C.NaNO2有氧化性:2I- + 2H+ + 2NO2-= I2 + 2NO2↑ + H2O
D.NaNO2有还原性:Cr2O72- + 3NO2-+ 8H+=3NO3- + 2Cr3+ + 4H2O
【答案】C
【解析】
A. 由实验①,NaNO2溶液加入酚酞溶液变红,说明溶液呈碱性,说明NaNO2属于强碱弱酸盐:NO2- +H2O![]() HNO2 +OH-,故A正确;
HNO2 +OH-,故A正确;
B. 由实验②,NaNO2溶液中加入硝酸银,产生淡黄色沉淀,说明可与某些盐发生复分解反应:NO2- + Ag+= AgNO2↓,故B正确;
C. 由实验③,NaNO2溶液中加入淀粉碘化钾溶液和硫酸溶液,溶液变蓝,说明碘离子变为碘单质使淀粉变蓝,碘元素由-1价变为0价做还原剂,则可证明NaNO2有氧化性,氮元素化合价应降低:2I-+ 2H+ + NO2-= I2 + NO↑ + H2O,故C错误;
D. 由实验④,NaNO2溶液中加入酸性重铬酸钾溶液,溶液变为浅绿色,说明生成+3价铬离子,铬元素由+6价变为+3价,化合价降低,重铬酸钾为氧化剂,则NaNO2为还原剂,说明NaNO2有还原性,发生的反应为:Cr2O72-+ 3NO2-+ 8H+=3NO3-+ 2Cr3+ + 4H2O,故D正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】N2和H2在催化剂表面合成氨的微观历程及能量变化的示意图如下,用![]() 、
、![]() 、
、![]() 分别表示N2、H2、NH3,下列说法正确的是( )
分别表示N2、H2、NH3,下列说法正确的是( )
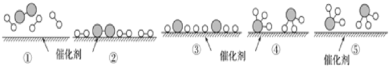
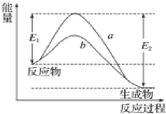
A.使用催化剂,改变了反应的途径,使合成氨反应放出的热量减少
B.该过程中,N2、H2吸收能量后断键形成N原子和H原子
C.该过程中,N原子和H原子形成含有非极性键的NH3分子
D.合成氨反应中,反应物断键吸收能量大于生成物形成新键释放的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种放射性核素,可治疗多种皮肤病。下列有关该核素说法正确的是
是一种放射性核素,可治疗多种皮肤病。下列有关该核素说法正确的是
A. ![]() 的摩尔质量是32
的摩尔质量是32
B. ![]() 和
和![]() 互称为同位素
互称为同位素
C. 1mol ![]() 含质子数约为32×6.02×1023
含质子数约为32×6.02×1023
D. 由质量数可以判断其在周期表的位置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下。下列说法正确的是( )
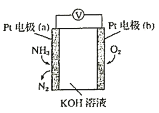
A.O2在电极b上发生氧化反应
B.溶液中OH-向电极b移动
C.反应消耗的NH3与O2的物质的量之比为4:3
D.正极的电极反应式为2NH3-6e-+6OH-=N2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院科研团队研究表明,在常温常压和可见光下,基于![]() (一种固体催化剂)合成
(一种固体催化剂)合成![]() 的原理示意图如下。试回答下列问题:
的原理示意图如下。试回答下列问题:
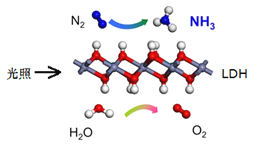
(1)从能量转换的角度,该过程将______转化成为__________;
(2)该反应的化学方程式为:________________,氧化剂与还原剂的物质的量之比为__________;
(3)关于该反应的说法,正确的是_______
A.催化剂能增大化学反应速率,缩短反应时间,从而提高产氨效率
B.该反应过程中涉及极性键和非极性键的断裂和形成
C.可以通过分离液态空气的方法获得氮气
D.基于![]() 合成
合成![]() 的过程属于人工固氮
的过程属于人工固氮
(4)现代工业常以氯化钠、二氧化碳和氨气为原料制备纯碱。加入原料的顺序是:在氯化钠溶液,通入_________至饱和,再通入足量的_________可制得![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲苯是对煤的综合利用得到的产物之一,其结构简式如下图。试回答下列问题:
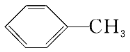
(1)苯与甲苯的相互关系为________。
A.同分异构体 B.同位素
C.同素异形体 D.同系物
(2)甲苯燃烧时的现象为____________________________________,1 mol 甲苯完全燃烧消耗氧气的物质的量为_____________________。
(3)甲苯的二氯代物有________种。试写出其中的两种_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室备有质量分数为98%,密度为1.84 g·cm-3的硫酸,据此下列说法错误的是 ( )
A. 该硫酸的物质的量浓度为18.4 mol·L-1
B. 该硫酸50 mL与足量的铜反应可得到标准状况下SO2 0.46 mol
C. 某同学用该硫酸配制稀硫酸时,未洗涤烧杯和玻璃棒,会造成最终配制的稀硫酸浓度偏低
D. 等质量的水与该硫酸混合所得溶液的物质的量浓度小于9.2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均是短周期主族元素,其原子序数依次增大,A和B同周期,A和D同主族,A原子最外层电子数是内层电子数的二倍,B元素族序数是周期数的三倍,B的阴离子与C的阳离子电子层结构相同,C的单质与B的单质在不同条件下反应,可生成C2B或C2B2,E是所在周期中原子半径最小的元素,请回答:
(1)D在元素周期表中的位置是___________。
(2)C2B2的电子式是________。
(3)B、C、E的离子半径由大到小的顺序为________(用离子符号回答);A、D、E元素最高价氧化物对应水化物的酸性由强到弱为_________(用化学式回答,下同),B的气态氢化物与H2S相比沸点高的是_____,原因是___________________________。
(4)写出D的氧化物与氢氟酸反应的化学方程式____________________________________。
(5)1mol C2B2与足量的水反应转移电子的物质的量是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,其性质和制备受到人们的关注。已知N2O5能与水发生反应,并放出大量的热。
Ⅰ.一定温度下,在恒容密闭容器中N2O5发生下列反应:2N2O5(g)![]() 4NO2(g)+O2(g)ΔH。
4NO2(g)+O2(g)ΔH。
(1)下表为反应在T1温度下的部分实验数据:
t/s | 0 | 500 | 1000 |
c(N2O5)/mol·L—1 | 5.00 | 3.52 | 2.48 |
则500s内NO2的生成速率为______________。
(2)反应达到平衡后,若再通入一定量N2O5,达到新平衡时,N2O5的转化率将______(填“增大”、“减小”、“不变”)。
(3)在温度T1和T2时,N2O5的浓度与反应时间的关系如图所示。据此判断:T1______T2(填“>”、“<”或“=”,下同),ΔH______0。
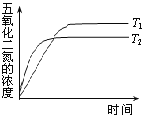
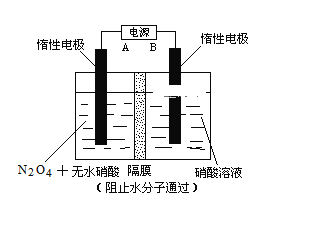
Ⅱ.下图所示装置,可用于制备N2O5气体。A是电源的____________(填“负极”或“正极”),电解池的阳极反应式为______________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com