

| A. | 正极反应为Ag-e-=Ag+ | |
| B. | 放电时,交换膜右侧溶液中有大量白色沉淀生成 | |
| C. | 当电路中转移0.1mol e-,通过交换膜的阳离子为0.2mol | |
| D. | 用KCl溶液代替盐酸,则电池总反应不改变 |
分析 根据电池总反应为2Ag+Cl2═2AgCl可知,Ag失电子作负极失电子,氯气在正极上得电子生成氯离子,
A、正极上氯气得电子;
B、阳离子交换膜只能阳离子通过;
C、放电时,当电路中转移0.1mol e-时,交换膜左则会有0.1mol氢离子通过阳离子交换膜向正极移动;
D、根据电池总反应判断.
解答 解:根据电池总反应为2Ag+Cl2═2AgCl可知,Ag失电子作负极失电子,氯气在正极上得电子生成氯离子,
A、正极上氯气得电子生成氯离子,其电极反应为:Cl2+2e-═2Cl-,故A错误;
B、放电时,左侧Ag溶解生成银离子,银离子和氯离子反应生成AgCl沉淀,所以左侧生成白色沉淀,左侧氢离子通过离子交换膜进入右侧,故B错误;
C、放电时,当电路中转移0.1mol e-时,交换膜左则会有0.1mol氢离子通过阳离子交换膜向正极移动,故C错误;
D、根据电池总反应为2Ag+Cl2═2AgCl可知,用KCl溶液代替盐酸,电池的总反应不变,故D正确;
故选D.
点评 本题考查了原电池原理的应用及沉淀反应,注意把握原电池原理及正负极的判断和电极方程式的书写,利用电子及电荷守恒来解决原电池中有关计算的问题,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 熔点:金刚石>食盐>干冰 | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 沸点:HF>HBr>HCl | D. | 离子半径:Na+<Mg2+<Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{1}^{2}$H原子的中子数和质子数 | |
| B. | ${\;}_{18}^{36}$Ar原子中的质量数和中子数 | |
| C. | ${\;}_{4}^{8}$Be2+离子中的电子数和质子数 | |
| D. | ${\;}_{12}^{26}$Mg2+离子中的中子数和电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

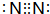 ,E的化学式为NO.
,E的化学式为NO.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 溴乙烷与氢氧化钠水溶液共热 | |
| B. | 溴乙烷与氧氧化钠的乙醇溶液共热 | |
| C. | 甲烷与氯气反应 | |
| D. | 乙炔与氯化氢在一定条件下制氯乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两性氧化物 | B. | 两性氢氧化物 | C. | 盐 | D. | 有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液颜色保持不变,说明上述可逆反应达到平衡状态 | |
| B. | 若用绿矾(FeS04•7H2O)作还原剂,处理1 L废水,至少需要458.7g | |
| C. | 常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=5 | |
| D. | 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol/L,应调溶液的pH=5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
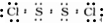 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “加碘食盐”、“含氟牙膏”、“富硒营养品”、“高钙牛奶”、“加铁酱油”等等,这里的碘、氟、硒指的是对应的单质分子,而钙、铁则指的是对应的钙离子和铁离子 | |
| B. | 淀粉及做衣服的棉和麻均为天然高分子化合物 | |
| C. | 煎炸食物的花生油和牛油都是可水解的饱和酯类 | |
| D. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com