


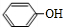
 ,G
,G .
. .
. 氮原子上的氢原子可以像A上的氢原子那样与C发生加成反应,再缩聚成高分子化合物.写出尿素与C在一定条件下生成线性高分子化合物的化学方程式
氮原子上的氢原子可以像A上的氢原子那样与C发生加成反应,再缩聚成高分子化合物.写出尿素与C在一定条件下生成线性高分子化合物的化学方程式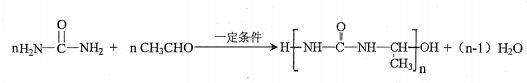 .
.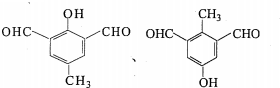 (任一种).
(任一种).分析 A是一种烃的含氧衍生物,其相对分子质量小于100,碳、氢元素质量分数之和为82.98%,则分子中O原子最大数目为 $\frac{100×(1-82.98%)}{16}$≈1.1,则氧原子数目为1,故Mr(A)=$\frac{16}{1-82.98%}$=94,分子中C、H原子总相对原子质量为94-16=78,则分子中C原子最大数目 $\frac{78}{12}$=6…6,则分子中C、H原子数目均为6,则A的分子式为C6H6O,A转化得到B,结合B的结构简式可知A为 ,C与银氨溶液反应得到D,D转化得到E,结合D的分子式与E的结构简式可知D为CH3COOH、C为CH3CHO,由F的结构简式可知,B与E发生加成反应得到F,对比G的分子式与F的结构、结合H的结构简式可知,F发生消去反应得到G,则G为
,C与银氨溶液反应得到D,D转化得到E,结合D的分子式与E的结构简式可知D为CH3COOH、C为CH3CHO,由F的结构简式可知,B与E发生加成反应得到F,对比G的分子式与F的结构、结合H的结构简式可知,F发生消去反应得到G,则G为 ,G发生酯的水解反应得到H,结合Y的结构简式可知,H分子内脱去1分子水得到Y.由X的结构片段可知,苯酚与乙醛发生缩聚反应得到X.
,G发生酯的水解反应得到H,结合Y的结构简式可知,H分子内脱去1分子水得到Y.由X的结构片段可知,苯酚与乙醛发生缩聚反应得到X.
解答 解:A是一种烃的含氧衍生物,其相对分子质量小于100,碳、氢元素质量分数之和为82.98%,则分子中O原子最大数目为 $\frac{100×(1-82.98%)}{16}$≈1.1,则氧原子数目为1,故Mr(A)=$\frac{16}{1-82.98%}$=94,分子中C、H原子总相对原子质量为94-16=78,则分子中C原子最大数目 $\frac{78}{12}$=6…6,则分子中C、H原子数目均为6,则A的分子式为C6H6O,A转化得到B,结合B的结构简式可知A为 ,C与银氨溶液反应得到D,D转化得到E,结合D的分子式与E的结构简式可知D为CH3COOH、C为CH3CHO,由F的结构简式可知,B与E发生加成反应得到F,对比G的分子式与F的结构、结合H的结构简式可知,F发生消去反应得到G,则G为
,C与银氨溶液反应得到D,D转化得到E,结合D的分子式与E的结构简式可知D为CH3COOH、C为CH3CHO,由F的结构简式可知,B与E发生加成反应得到F,对比G的分子式与F的结构、结合H的结构简式可知,F发生消去反应得到G,则G为 ,G发生酯的水解反应得到H,结合Y的结构简式可知,H分子内脱去1分子水得到Y.由X的结构片段可知,苯酚与乙醛发生缩聚反应得到X.
,G发生酯的水解反应得到H,结合Y的结构简式可知,H分子内脱去1分子水得到Y.由X的结构片段可知,苯酚与乙醛发生缩聚反应得到X.
(l)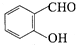 中的官能团名称为:醛基、羟基,故答案为:醛基、羟基;
中的官能团名称为:醛基、羟基,故答案为:醛基、羟基;
(2)A的结构简式为 ,G的结构简式为:
,G的结构简式为: ,
,
故答案为: ;
; ;
;
(3)a.B与E生成F是甲基与醛发生的加成反应,故a正确;
b.G为 ,苯环与碳碳双键能与氢气发生加成反应,1molG最多能与4molH2发生加成反应,故b错误;
,苯环与碳碳双键能与氢气发生加成反应,1molG最多能与4molH2发生加成反应,故b错误;
c.Y含有羧酸与酚形成的酯基,水解得到羧基、酚羟基,与氢氧化钠水溶液反应时,1molY最多能消耗2mol NaOH,故c正确,
故答案为:ac;
(4)H生成Y的化学方程式为: ,
,
故答案为: ;
;
(5)尿素 氮原子上的氢原子可以像A上的氢原子那样与C发生加成反应,再缩聚成高分子化合物,尿素与C在一定条件下生成线性高分子化合物的化学方程式:
氮原子上的氢原子可以像A上的氢原子那样与C发生加成反应,再缩聚成高分子化合物,尿素与C在一定条件下生成线性高分子化合物的化学方程式: ,
,
故答案为: ;
;
(6)H的同分异构体中能同时满足如下条件:
①可发生银镜反应,说明含有醛基,②只含有一个环状结构且可使FeCl3溶液显紫色,说明含有酚羟基,
③核磁共振氢谱为四组峰,且峰面积比为3:2:2:1,符合条件同分异构体有: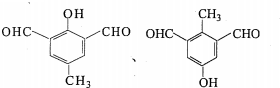 ,共2种
,共2种
故答案为:2;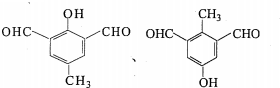 (任一种).
(任一种).
点评 本题考查有机物的推断与合成,关键是计算确定A的分子式,充分利用转化中有机物的分子式与结构简式进行分析,熟练掌握官能团的性质与转化,较好的考查学生分析推理能力、知识迁移应用能力.


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两者的质量数不同 | B. | 两者的中子数不同 | ||
| C. | 两者的核外电子数相同 | D. | 两者互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸钠溶液可用于环境的消毒杀菌 | |
| B. | 红葡萄酒营养丰富(含葡萄糖、维生素C等),常添加微量的二氧化硫,利用二氧化硫还原性,防止红葡萄酒中某营养成分被氧化 | |
| C. | 某雨水放置一段时间后pH由4.68变为4.28,因为水中亚硫酸被空气中氧气氧化成硫酸 | |
| D. | 医疗上可用硫酸钡作X射线透视肠胃的内服药,是因为硫酸钡不溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
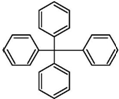 甲烷分子中的4个氢原子全部被苯基取代,所得物质的分子结构如图所示,对该物质的描述不正确的是( )
甲烷分子中的4个氢原子全部被苯基取代,所得物质的分子结构如图所示,对该物质的描述不正确的是( )| A. | 其分子式为C25H20 | |
| B. | 分子内的所有碳原子不可能共平面 | |
| C. | 该物质光照下可和氯气发生反应 | |
| D. | 该物质在Fe粉催化下可和液溴发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 | 7.6 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 | 10.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com