
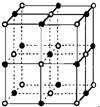
 决定物质性质的重要因素是物质结构.请回答下列问题:
决定物质性质的重要因素是物质结构.请回答下列问题:| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
| 共价键 | C-C | C-N | C-S |
| 键能/kJ•mol-1 | 347 | 305 | 259 |
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
分析 (1)A和B为第三周期元素,根据其电离能知,A第三电离能和第四电离能相差较大,说明A最外层有3个电子,为Al元素;B第二电离能和第三电离能相差较大,说明B原子最外层有2个电子,为Mg元素;
主族元素最高正化合价与其族序数相等但O、F元素除外;同一周期元素,元素电负性随着原子序数增大而增大;
(2)光子能量大于C-C、C-N、C-S键的键能,从而导致这些化学键易断裂;根据价层电子对互斥理论确定碳原子杂化类型;
(3)离子晶体中晶格能越大其熔沸点越高,晶格能与电荷成正比、与半径成反比;根据氯化钠中钠离子配位数确定MgO中镁离子配位数;
(4)同种非金属元素以形成非极性共价键、不同非金属元素易形成极性共价键、阴阳离子之间易形成离子键,含有空轨道和含有孤电子对的原子之间易形成配位键;
根据氯化钠晶胞知,该晶胞中([LiC60]+、PF6-个数都是4,边长anm=a×10-7cm,体积为(a×10-7)3cm3,密度$ρ=\frac{m}{M}$.
解答 解:(1)A和B为第三周期元素,根据其电离能知,A第三电离能和第四电离能相差较大,说明A最外层有3个电子,为Al元素;B第二电离能和第三电离能相差较大,说明B原子最外层有2个电子,为Mg元素;
主族元素最高正化合价与其族序数相等但O、F元素除外,所以A通常显+3价;同一周期元素,元素电负性随着原子序数增大而增大,所以电负性Mg<Al,
故答案为:+3;>;
(2)光子能量大于C-C、C-N、C-S键的键能,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子;
蛋白质分子中部分碳原子价层电子对个数是3、部分是4,价层电子对个数是3的碳原子采用sp2杂化、价层电子对个数是4的原子采用sp3杂化,故答案为:紫外光具有的能量比蛋白质分子中主要化学键C-C、C-N、C-S的键能都大,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子;sp2、sp3;
(3)离子晶体中晶格能越大其熔沸点越高,晶格能与电荷成正比、与半径成反比,晶格能大小顺序是TiN>MgO>CaO>KCl,所以这几种晶体熔沸点高低顺序是TiN>MgO>CaO>KCl;
氯化钠晶胞中钠离子周围最近且距离相等的钠离子个数是3×8×$\frac{1}{2}$=12,根据氯化钠晶胞结构知,MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有12个;
故答案为:TiN>MgO>CaO>KCl;12;
(4)同种非金属元素以形成非极性共价键、不同非金属元素易形成极性共价键、阴阳离子之间易形成离子键,含有空轨道和含有孤电子对的原子之间易形成配位键,该化学式中C-C之间存在非极性键、P-B之间存在极性键、阴阳离子之间存在离子键;
根据氯化钠晶胞知,该晶胞中([LiC60]+、PF6-个数都是4,边长anm=a×10-7cm,体积为(a×10-7)3cm3,密度$ρ=\frac{m}{M}$=$\frac{\frac{M}{{N}_{A}}×4}{V}$=$\frac{\frac{872}{{N}_{A}}×4}{(a×1{0}^{-7})^{3}}$g/cm3=$\frac{3488}{(a×1{0}^{-7})^{3}{N}_{A}}$g/cm3,
故答案为:BCD;$\frac{3488}{(a×1{0}^{-7})^{3}{N}_{A}}$.
点评 本题考查晶胞计算、原子杂化、晶格能、电离能等知识点,为高考高频点,侧重考查学生分析计算能力,难点是晶胞计算,知道计算密度时$\frac{M}{{N}_{A}}$的含义是解(4)题关键,题目难度中等.


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ⑤④③①② | C. | ②④③①⑤ | D. | ③④②①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向铜片中滴加浓硫酸并加热,有刺激性气味气体产生:Cu+4H++SO42- $\frac{\underline{\;\;△\;\;}}{\;}$Cu2++SO2↑+2H2O | |
| B. | 服用阿司匹林过量出现水杨酸( )中毒反应,可静脉注射NaHCO3溶液: )中毒反应,可静脉注射NaHCO3溶液: +2 HCO3-→+2 CO2↑+2 H2O +2 HCO3-→+2 CO2↑+2 H2O | |
| C. | 20mL 1.0mol/L的明矾溶液与10mL 3.5mol/LBa(OH)2溶液混合充分反应:3Ba2++6OH-+2Al3++3SO42-═3BaSO4↓+2Al(OH)3↓ | |
| D. | 向Ca(HCO3)2溶液中加入过量NaOH溶液,有白色沉淀生成:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 一种光化学电池的结构如图,当光照在表面涂有氯化银的银片上时,AgCl(s)=AgCl(s)=Ag (s)+Cl(AgCl),[Cl(AgCl)表示生成的氯原子吸附在氯化银表面],接着Cl(AgCl)+e-→Cl-(aq),若将光源移除,电池会立即回复至初始状态.下列说法正确的是( )
一种光化学电池的结构如图,当光照在表面涂有氯化银的银片上时,AgCl(s)=AgCl(s)=Ag (s)+Cl(AgCl),[Cl(AgCl)表示生成的氯原子吸附在氯化银表面],接着Cl(AgCl)+e-→Cl-(aq),若将光源移除,电池会立即回复至初始状态.下列说法正确的是( )| A. | 光照时,电流由Y流向X | |
| B. | 光照时,Pt电极发生的反应为2Cl-+2e-=Cl2 | |
| C. | 光照时,Cl-向Ag电极移动 | |
| D. | 光照时,电池总反应为:AgCl(s)+Cu+(aq)$\frac{\underline{\;光\;}}{\;}$Ag (s)+Cu2+(aq)+Cl-(aq) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2、Cl2O7都是酸性氧化物 | B. | 水银、水玻璃都是混合物 | ||
| C. | HD、HCHO都是极性分子 | D. | 干冰、可燃冰都是分子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PVC的单体是CH3CH2Cl | |
| B. | PVC是高分子化合物 | |
| C. | PVC能够使溴的四氯化碳溶液褪色 | |
| D. | PVC保鲜膜最适合用来包装蔬菜、水果及熟食 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的比例模型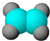 | B. | 1,3-丁二烯的键线式: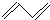 | ||
| C. | 甲基的电子式: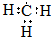 | D. | 乙醚的结构简式:CH3OCH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com