
| A. | 加入催化剂,反应途径将发生改变,但△H不会改变 | |
| B. | 升高温度,正逆反应速率都增大,H2S分解率也增大 | |
| C. | 增大压强,平衡向逆反应方向移动,将引起体系温度升高 | |
| D. | 若体系恒容,注入一些H2后平衡逆向移动,达到新平衡,H2浓度比原平衡小 |
分析 A.反应热只有始态、终态有关,与反应途径无关;
B.升高温度,正逆反应速率都增大,平衡向正反应方向移动;
C.增大压强,平衡逆反应方向移动;
D.若体系恒容,加入一些H2后达新平衡,平衡虽然想逆反应方向移动,但不能消除氢气浓度增大.
解答 解:A.加入催化剂,降低活化能,反应途径将发生改变,但反应热只有始态、终态有关,与反应途径无关,故反应热不变,故A正确;
B.正反应为吸热反应,升高温度,正逆反应速率都增大,平衡向正反应方向移动,硫化氢的分解率增大,故B正确;
C.正反应为体积增大的吸热反应,增大压强,平衡逆反应方向移动,体系温度升高,故C正确;
D.若体系恒容,加入一些H2后达新平衡,平衡虽然想逆反应方向移动,但不能消除氢气浓度增大,达新平衡后H2浓度将增大,故D错误;
故选D.
点评 本题考查化学平衡的影响因素,难度不大,D选项为易错点,学生容易认为平衡向逆反应移动,浓度降低,注意根据平衡移动原理理解或利用平衡常数理解.


科目:高中化学 来源: 题型:选择题
| A. | 24.2g | B. | 23.8g | C. | 23.2g | D. | 24.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
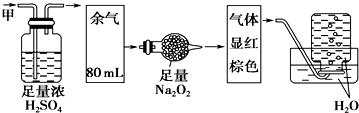
| A. | NH3、NO2、N2 | B. | NH3、NO、CO2 | C. | HCl、NO2、CO2 | D. | NO、CO2、N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 利用图1除去Cl2中的HCl | |
| B. | 利用图2由45°白酒制无水乙醇 | |
| C. | 利用图3检验产物中含有乙烯 | |
| D. | 图4是研究温度对NO2和N2O4平衡的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
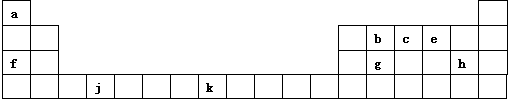
 ,这样排布遵循了构造原理、泡利原理和洪特规则.
,这样排布遵循了构造原理、泡利原理和洪特规则.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纤维素被人体消化吸收后提供营养物质 | |
| B. | 能发生水解反应的不一定是糖类,但糖类一定能发生水解反应 | |
| C. | 没有成熟的苹果汁遇碘变蓝色,成熟的苹果汁能还原新制氢氧化铜悬浊液 | |
| D. | 1 mol二糖完全水解一定能够生成2 mol葡萄糖 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com