
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
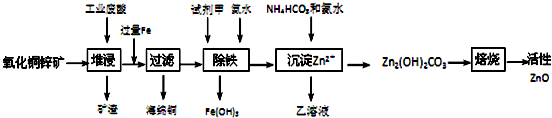
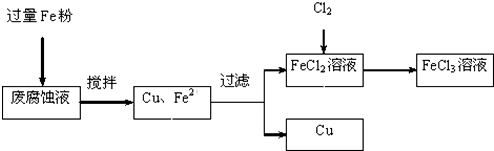
分析 氧化铜锌矿先用稀硫酸溶解,然后过滤分离出矿渣,向所得溶液中加入过量Fe将Cu铜置换出来,得到海绵铜,向滤液中加入试剂甲、氨水除去铁,加氧化剂将Fe2+氧化成Fe3+,加氨水调节溶液的pH,过滤将其除去,再用NH4HCO3洗涤溶液,得到溶解度较小的碱式碳酸锌,最后焙烧得到ZnO,乙的溶液可直接用作氮肥,乙溶液为(NH4)2SO4,
(1)相同条件下,溶解度大的物质先溶解;
(2)除铁过程中,要将亚铁离子转化为铁离子,然后用氨水除去铁离子,试剂甲具有氧化性且不能引进新的杂质;
(3)pH的范围应是使铁离子沉淀完全而锌离子不沉淀;
(4)铁离子和一水合氨反应生成氢氧化铁沉淀和铵根离子;
(5)锌离子开始沉淀时溶液的pH=6.2,溶液中c(OH-)=10-7.8 mol/L,c(Fe3+)=$\frac{{K}_{sp}}{{c}^{3}(O{H}^{-})}$;
(6)结合题给信息利用工业废酸和氮肥考虑;
(7)硫酸锌、碳酸氢铵和一水合氨反应生成碱式碳酸锌和硫酸铵、水.
解答 解:氧化铜锌矿先用稀硫酸溶解,然后过滤分离出矿渣,向所得溶液中加入过量Fe将Cu铜置换出来,得到海绵铜,向滤液中加入试剂甲、氨水除去铁,加氧化剂将Fe2+氧化成Fe3+,加氨水调节溶液的pH,过滤将其除去,再用NH4HCO3洗涤溶液,得到溶解度较小的碱式碳酸锌,最后焙烧得到ZnO,乙的溶液可直接用作氮肥,乙溶液为(NH4)2SO4,
(1)相同条件下,溶解度大的物质先溶解,因在H2SO4的作用下ZnS可以溶解而CuS不溶,则相同温度下:Ksp(CuS)<Ksp(ZnS),故答案为:<;
(2)除铁过程中,要将亚铁离子转化为铁离子,然后用氨水除去铁离子,试剂甲具有氧化性且不能引进新的杂质,高锰酸钾、硝酸、氯气都具有强氧化性但能引进新的杂质,所以应该选取双氧水,双氧水被还原生成水,故选C;
(3)从图表数据可知,铁离子沉淀完全的pH为3.2,锌离子开始沉淀的pH为6.2.故除铁pH范围为:3.2~6.2,故答案为:3.2~6.2;
(4)铁离子和一水合氨反应生成氢氧化铁沉淀和铵根离子,离子方程式为Fe3++3NH3•H2O═Fe﹙OH)3↓+3NH4+,故答案为:Fe3++3NH3•H2O═Fe﹙OH)3↓+3NH4+;
(5)锌离子开始沉淀时溶液的pH=6.2,溶液中c(OH-)=10-7.8 mol/L,c(Fe3+)=$\frac{{K}_{sp}}{{c}^{3}(O{H}^{-})}$=$\frac{2.70×1{0}^{-39}}{(1{0}^{-7.8})^{3}}$mol/L=2.7×10-15.6mol/L,故答案为:2.7×10-15.6;
2.7×10-20.4
(6)因所用废酸为硫酸,乙又可作氮肥,所以乙为(NH4)2SO4,
故答案为:(NH4)2SO4;
(7)硫酸锌、碳酸氢铵和一水合氨反应生成碱式碳酸锌和硫酸铵、水,反应方程式为2ZnSO4+NH4HCO3+3NH3.H2O═Zn2(OH)2CO3↓+2(NH4)2SO4+H2O,故答案为:2ZnSO4+NH4HCO3+3NH3.H2O═Zn2(OH)2CO3↓+2(NH4)2SO4+H2O.
点评 本题考查物质分离和提纯,为高频考点,侧重考查学生知识综合应用能力,明确物质性质及物质分离和提纯方法是解本题关键,难点是计算铁离子浓度,知道流程图中各部分可能发生的反应、采用的分离方法,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 有单质参加或有单质生成的反应一定是氧化还原反应 | |
| B. | 氧化还原的本质是元素化合价的升降 | |
| C. | 失电子越多,该物质的还原性就越强 | |
| D. | 金属单质在化学反应中一定作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
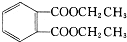 )是一种重要的工业塑化剂,其合成路线很多,下图就是其中的一种合成方法:
)是一种重要的工业塑化剂,其合成路线很多,下图就是其中的一种合成方法: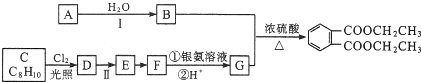
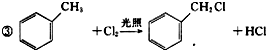
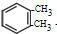 +2Cl2$\stackrel{光照}{→}$
+2Cl2$\stackrel{光照}{→}$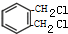 +2HCl.
+2HCl. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 500 mL容量瓶,58.5 gNaCl | B. | 500 mL容量瓶,117 g NaCl | ||
| C. | 1 000 mL容量瓶,58.5 g NaCl | D. | 1 000 mL容量瓶,117 g NaC1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 营养平衡、合理用药是保证人体健康和生活质量的重要途径.
营养平衡、合理用药是保证人体健康和生活质量的重要途径.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com