
��2013?������ģ��̼����-��������Ӻ��aNa
2CO
3?bH
2O
2������Ư�ס�ɱ�����ã�ʵ�����á����������Ʊ������ʵ�ʵ�鲽�����£�
��1����ȡ����̼�����ܽ���һ����ˮ�У�������ƿ�У��ټ��������ȶ�����MgCl
2��Na
2SiO
3����������ȣ�
��2����������30%��H
2O
2��Һ�ڽ���״̬�µ�����ƿ�У���15�����ҷ�Ӧ1h��
��3������Ӧ��Ϻ��ټ���������ˮ�Ҵ������á��ᾧ�����ˡ�����ò�Ʒ��
��1����1���У��ȶ�����ˮ��Ӧ����2�ֳ�����������仯ѧ����ʽΪ
MgCl2+Na2SiO3+2H2O=2NaCl+Mg��OH��2��+H2SiO3��
MgCl2+Na2SiO3+2H2O=2NaCl+Mg��OH��2��+H2SiO3��
��
��2����2���У���Ӧ����Ϊ15�����ҿɲ�ȡ�Ĵ�ʩ��
15��ˮԡ����ˮԡ
15��ˮԡ����ˮԡ
��
��3����3���У���ˮ�Ҵ���������
����̼����-�������⻯������ܽ�ȣ������ھ���������
����̼����-�������⻯������ܽ�ȣ������ھ���������
��
��4��H
2O
2�ĺ����ɺ�����Ʒ�����ӣ��ֳ�ȡm g��Լ0.5g����Ʒ��������й�������ˮ���Ƴ�250mL��Һ��ȡ25.0mL����ƿ�У�����ϡ�����ữ������c mol?L
-1 KMnO
4��Һ�ζ����յ㣮
������250mL��Һ����IJ����������ձ�������������Ͳ��
��250mL������ƿ
��250mL������ƿ
��
��ͷ�ι�
��ͷ�ι�
��
�ڵζ��յ�۲쵽��������
��Һ��dz��ɫ��30s�ڲ���ɫ
��Һ��dz��ɫ��30s�ڲ���ɫ
��
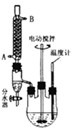
��5����ģ�������ⶨ��Ʒ��̼���Ƶĺ�����װ����ͼ��ʾ�����Ⱥ̶�װ������ȥ����ʵ�鲽�����£�
����1������ͼ��ʾ��װ���������װ�������ԣ�
����2��ȷ��ȡ��4����������Һ50mL����ƿ�У�
����3��ȷ��ȡ40.00mLԼ0.2mol?NaOH��Һ2�ݣ��ֱ�ע���ձ�����ƿ�У�
����4������k
1��k
2���رջ���k
3������ͨ�뵪��һ��ʱ��ر�k
1��k
2����k
3������Һ©������ƿ�м���10mL 3mol?������Һ��
����5����������ƿ�е�Һ����ڣ���������һ��ʱ�䣮
����6����k
1�ٻ���ͨ�뵪��һ��ʱ�䣮
����7������ƿ�м������ָʾ������c
1 mol?H
2SO
4����Һ�ζ����յ㣬����H
2SO
4����ҺV
1 mL��
����8����ʵ�鲽��1��7�ظ�2�Σ�
�ٲ���3�У�ȷ��ȡ40.00mL NaOH��Һ����Ҫʹ�õ�������
��ʽ�ζ���
��ʽ�ζ���
��
�ڲ���1��7�У�ȷ�����ɵĶ�����̼������������Һ��ȫ���յ�ʵ�鲽����
1��5��6
1��5��6
������ţ���
��Ϊ�����Ʒ��̼���Ƶĺ��������貹���ʵ����
��H2SO4����Һ�궨NaOH��Һ��Ũ��
��H2SO4����Һ�궨NaOH��Һ��Ũ��
��

 ��ͼ��ʾ�����ַ�Ӧ�������¶Ȳ��䣬��һ���ݻ�Ϊ4L���ܱ������У����Ҽ���X molSO3�����Ҽ���2 molSO2��1molO2���м��Ǹ����ƶ��ĸ��壬���������������·ֱ�����Ӧ��
��ͼ��ʾ�����ַ�Ӧ�������¶Ȳ��䣬��һ���ݻ�Ϊ4L���ܱ������У����Ҽ���X molSO3�����Ҽ���2 molSO2��1molO2���м��Ǹ����ƶ��ĸ��壬���������������·ֱ�����Ӧ��


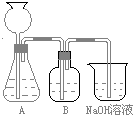
 ��2013?��ģ�⣩������ܻ����ڱ�����������������ڱ�������������������Ũ���Ṳ���·�Ӧ�Ƶã���Ӧ�Ļ�ѧ����ʽ��װ��ͼ������װ��ʡ�ԣ����£�
��2013?��ģ�⣩������ܻ����ڱ�����������������ڱ�������������������Ũ���Ṳ���·�Ӧ�Ƶã���Ӧ�Ļ�ѧ����ʽ��װ��ͼ������װ��ʡ�ԣ����£�


 ��2013?������ģ��̼����-��������Ӻ��aNa2CO3?bH2O2������Ư�ס�ɱ�����ã�ʵ�����á����������Ʊ������ʵ�ʵ�鲽�����£�
��2013?������ģ��̼����-��������Ӻ��aNa2CO3?bH2O2������Ư�ס�ɱ�����ã�ʵ�����á����������Ʊ������ʵ�ʵ�鲽�����£�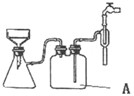 �������ڿ������ױ����������γɸ��ο��ȶ����ڣ����������[��NH4��2SO4?FeSO4?6H2O]Ϊdz��ɫ���壬��Ʒ��ΪĦ���Σ�������ˮ���������Ҵ��� ͨ���������²�����ʵ�����������Ʊ���
�������ڿ������ױ����������γɸ��ο��ȶ����ڣ����������[��NH4��2SO4?FeSO4?6H2O]Ϊdz��ɫ���壬��Ʒ��ΪĦ���Σ�������ˮ���������Ҵ��� ͨ���������²�����ʵ�����������Ʊ���