
【题目】R、Q、X、Y、Z是原子序数依次增大的五种短周期元素,R与Q形成的气态化合物,在标准下的密度为0.76 g/L,X、Y、Z三种元素族序数之和为10,Y是地壳中含量最多的金属元素,Y单质能强碱溶液反应,Z元素原子最外层电子数是电子层数的两倍。
(1)X在周期表中的位置 ;X、Y、Z三种元素形成的简单离子半径由大到小的顺序是 。(用离子符号回答)
(2)X和R两种元素按原子个数比1:1组成的化合物的电子式为 ,推测这种化合物具有较强的 。(填“氧化性”或“还原性”)
(3)写出Y、Z两种元素最高价氧化物对应的水化物相反应的离子方程式: 。
(4)水的沸点远高于Z元素的氢化物的沸点,原因是 。
(5)Q4是一种Q元素的新单质,可用作推进剂或炸药,推算其分子中含有 对共用电子。
(6)由R、Q两元素组成的一种液态化合物W常用作还原剂,W分子中含有18个电子,W分子的结构式为 。W与氢氧化铜悬浊液反应生成氧化亚铜,同时产生一种稳定的气态单质,该反应的化学方程式为 。
【答案】(1)第三周期第IA族 , S2->Na+>Al3+ ;
(2)![]() ;还原性;
;还原性;
(3)Al(OH)3 + 3H+ = Al3+ + 3H2O
(4)水分子之间形成氢键
(5)6
(6)![]() , 4Cu(OH)2 + N2H4 = 2Cu2O + N2↑ + 6H2O。
, 4Cu(OH)2 + N2H4 = 2Cu2O + N2↑ + 6H2O。
【解析】试题分析:R、Q、X、Y、Z是原子序数依次增大的五种短周期元素,R与Q形成的气态化合物,在标准下的密度为0.76 g/L,M="0.76" g/L ×22.4L/mol=17g/mol,所以R是H元素,Q是N元素;X、Y、Z三种元素族序数之和为10,Y是地壳中含量最多的金属元素,Y单质能强碱溶液反应,则Y是Al元素,Z元素原子最外层电子数是电子层数的两倍,则Z是S元素,所以X元素的族序数是10-3-6=1,X是Na元素。(1)X是Na元素,在周期表中的位置是第三周期第IA族;X、Y、Z三种元素形成的简单离子半径分别是Na+、Al3+、S2-。对于电子层数相同的元素来说,核电荷数越大,离子半径越小;对于电子层数不同的离子来说,离子核外电子层数越大,离子半径就越大,所以三种离子的半径由大到小的顺序是S2->Na+>Al3+;(2)X和R两种元素按原子个数比1:1组成的化合物是NaH,该物质是离子化合物,电子式为![]() ,推测这种化合物具有较强的H-具有强的还原性,容易失去电子,所以该物质具有强的还原性;(3)Y、Z两种元素最高价氧化物对应的水化物分别是Al(OH)3、H2SO4,前者是两性氢氧化物。可以与强酸硫酸发生反应产生硫酸铝和水,二者相反应的离子方程式:Al(OH)3 + 3H+ = Al3+ + 3H2O。(4)水的沸点远高于Z元素的氢化物H2S的沸点,是由于水分子之间存在氢键,增加了分子之间的吸引力,使物质的熔沸点升高;(5)Q4是一种Q元素的新单质,可用作推进剂或炸药,根据同族元素形成的物质结构的相似性,与P4类似,P4分子中有6个共价键,推算其分子中含有6对共用电子。(6)由R、Q两元素组成的一种液态化合物W常用作还原剂,W分子中含有18个电子,W分子是N2H4,分子的结构式为
,推测这种化合物具有较强的H-具有强的还原性,容易失去电子,所以该物质具有强的还原性;(3)Y、Z两种元素最高价氧化物对应的水化物分别是Al(OH)3、H2SO4,前者是两性氢氧化物。可以与强酸硫酸发生反应产生硫酸铝和水,二者相反应的离子方程式:Al(OH)3 + 3H+ = Al3+ + 3H2O。(4)水的沸点远高于Z元素的氢化物H2S的沸点,是由于水分子之间存在氢键,增加了分子之间的吸引力,使物质的熔沸点升高;(5)Q4是一种Q元素的新单质,可用作推进剂或炸药,根据同族元素形成的物质结构的相似性,与P4类似,P4分子中有6个共价键,推算其分子中含有6对共用电子。(6)由R、Q两元素组成的一种液态化合物W常用作还原剂,W分子中含有18个电子,W分子是N2H4,分子的结构式为![]() 。W与氢氧化铜悬浊液反应生成氧化亚铜,同时产生一种稳定的气态单质N2,则根据原子守恒、电子守恒 可得该反应的化学方程式为4Cu(OH)2 + N2H4 = 2Cu2O + N2↑ + 6H2O。
。W与氢氧化铜悬浊液反应生成氧化亚铜,同时产生一种稳定的气态单质N2,则根据原子守恒、电子守恒 可得该反应的化学方程式为4Cu(OH)2 + N2H4 = 2Cu2O + N2↑ + 6H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。

(1)装置A中盛放亚硫酸钠的仪器名称是_____,其中发生反应的化学方程式为_____。
(2)实验过程中,装置B、C中发生的现象分别是____________、______________,这些现象分别说明SO2具有的性质是____和__;装置B中发生反应的离子方程式为__________。
(3)设计装置D的目的是____________________________________________________。
(4)尾气应用____________________溶液吸收(填试剂的化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知某烷烃分子中电子数为42。
(1)该烷烃的分子式为________________________。
(2)写出该烷烃分子的所有同分异构体的结构简式:_________________________。
(3)上述同分异构体中,在相同条件下沸点最低的是____________(写结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,下列有关溶液中微粒浓度关系的叙述正确的是
A.向0.1mol/LNH4Cl溶液中通入一定量氨气后:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.溶有等物质的量的NaClO、NaHCO5的溶液中:c(HClO)+c(ClO-)═c(HCO3-)+c(H2CO3)+2c(CO32-)
C.向CH3COONa溶液中滴加稀HCl至pH=7:c(Na+)>c(Cl-)=c(CH3COOH)
D.等体积等物质的量浓度CH3COOH溶液和CH3COONa溶液混合:
2c(H+)+c(CH3COOH)=c(CH3COO-)+2c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知700℃时,H2(g)+CO2(g)![]() H2O(g)+CO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2和CO2,起始浓度如下表所示.其中甲经2min达平衡时,v(H2O)为0.025mol/(Lmin),下列判断不正确的是( )
H2O(g)+CO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2和CO2,起始浓度如下表所示.其中甲经2min达平衡时,v(H2O)为0.025mol/(Lmin),下列判断不正确的是( )

A.平衡时,乙中CO2的转化率大于50%
B.当反应平衡时,丙中c(CO2)是甲中的2倍
C.温度升至800℃,上述反应平衡常数为![]() ,则正反应为吸热反应
,则正反应为吸热反应
D.其他条件不变,若起始时向容器乙中充入0.10mol/L H2和0.20 mol/L CO2,到达平衡时c (CO)与原容器乙达平衡时c (CO)不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语中正确的是
A.NH4HCO3溶液中加入足量的NaOH浓溶液:NH4+ + OH- = NH3↑ + H2O
B.向FeBr2溶液中滴加少量氯水:2Fe2+ + Cl2 = 2Fe3+ + 2Cl-
C.用电子式表示HCl的形成过程:![]()
D.硫磺在空气中燃烧:2S + 3O2 ![]() 2SO3
2SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年8月12日,天津滨海新区爆炸事故确认有氰化钠(NaCN)、亚硝酸钠等,氰化钠毒性很强,遇水、酸会产生有毒易燃氰化氢气体。氰化氢的沸点只有26摄氏度,因此相当容易挥发进入空气,这就大大增加了中毒的风险。同时氰化钠遇到亚硝酸钠会发生爆炸。回答下列问题
(1)写出氰化钠遇水产生氰化氢的离子方程式
(2)爆炸现场约700吨的氰化钠大约需要900吨的双氧水来处理。氰化钠与双氧水相遇后,会释放出氨气同时析出白色晶体碳酸氢钠,使得氰化钠的毒性大大降低,写出氰化钠与双氧水反应的化学方程式 。
(3)氰化钠遇到亚硝酸钠能生成氧化钠和两种无污染的气体发生爆炸,写出化学反应方程式 。
(4)爆炸残留在废水中的CN- 可以用Cr2O72-处理,拟定下列流程进行废水处理,
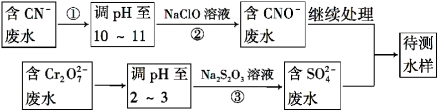
① 上述处理废水流程中主要使用的方法是 ;
A.混凝法 B.中和法 C.沉淀法 D.氧化还原法
② 步骤②反应无气体放出,该反应的离子方程式为_______________________;
③ 步骤③中,每处理0.4 mol Cr2O72 - 时转移电子2.4 mol,该反应的离子方程式为 ___________;
④处理酸性Cr2O72-废水多采用铁氧磁体法。该法是向废水中加入FeSO4·7H2O将Cr2O72-还原成Cr3+,调节pH,Fe、Cr转化成相当于FeⅡ[FexⅢCr(2-x)Ⅲ]O4(铁氧磁体,罗马数字表示元素价态)的沉淀。处理1 mol Cr2O72-,需加入amol FeSO4·7H2O,下列结论正确的是 。
A.x=0.5,a=6 B.x=0.5,a=10 C.x=1.5,a=6 D.x=1.5,a=10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向密闭容器中充入物质A和B,发生反应aA(g)+bB(g)![]() cC(g)。反应过程中,物质A的体积分数和C的体积分数随温度(T)的变化曲线如图所示,下列说法正确的是( )
cC(g)。反应过程中,物质A的体积分数和C的体积分数随温度(T)的变化曲线如图所示,下列说法正确的是( )
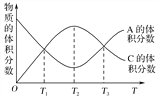
A. 该反应在T1、T3温度时达到化学平衡
B. 该反应在T2温度时达到化学平衡
C. 该反应的逆反应是放热反应
D. 升高温度,平衡会向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种高效低毒的农药“杀灭菊酯”的合成路线如下:
合成1: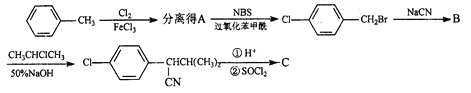
合成2:
合成3: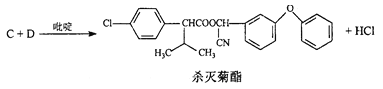
(1)![]() 中的官能团有____________________________(填名称)。
中的官能团有____________________________(填名称)。
(2)C的结构简式为_____________;合成3中的有机反应类型为______________。
(3)在合成2中,第一步和第二步的顺序不能颠倒,理由是______________。
(4)写出满足下列条件的D的同分异构体的结构简式______________。
①含有2个苯环 ②分子中有4种不同化学环境的氢 ③能发生水解反应
(5)已知:![]()
有机物E(![]() )是合成一种抗旱产药的重要中间体。根据已有知识并结合相关信息,写出以CH3Br和为有机原料(无机试剂和反应条件任选)合成E的路线流程图。合成路线流程图示例如下:
)是合成一种抗旱产药的重要中间体。根据已有知识并结合相关信息,写出以CH3Br和为有机原料(无机试剂和反应条件任选)合成E的路线流程图。合成路线流程图示例如下:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com