
可逆反应2NO2(g)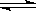 N2O4(g) △H<0。在密闭容器中进行,当达到平衡时,欲通过改变条件,达到新平衡后使气体颜色加深,应采取的措施是
N2O4(g) △H<0。在密闭容器中进行,当达到平衡时,欲通过改变条件,达到新平衡后使气体颜色加深,应采取的措施是
A.增大容器体积
B.温度压强不变,充入N2O4(g)
C.温度压强不变,充入NO2(g)
D.容器容积不变,升高温度
科目:高中化学 来源: 题型:
在恒温容器中,可逆反应H2(g)+ I2(g)  2HI(g)一定达平衡状态的是
2HI(g)一定达平衡状态的是
A.混合气的压强不变 B.混合气的体积不变
C.混合气的密度不变 D.有n个H-H键断裂的同时有2n个H-I键断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中进行可逆反应,A跟B反应生成C,反应速率v(A)、v(B)、v(C)之间存在以下关系:v(B)=3v(A),v(C)=2v(A),3v(C)=2v(B),则该反应可以表示为
A.A+B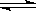 C B.2A+2B
C B.2A+2B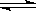 3C
3C
C.A+3B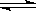 2C D. 3A+B
2C D. 3A+B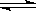 2C
2C
查看答案和解析>>
科目:高中化学 来源: 题型:
已知298K时,2SO2(g)+O2(g)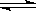 2SO3(g) ΔH=—197kJ/mol,在相同温度下,向固定体积的密闭容器中通入2molSO2和1molO2,达到平衡时放出热量Q1;向另一个同体积的密闭容器中通入1molSO2和0.5molO2,达到平衡时放出热量为Q2,则下列关系中正确的是
2SO3(g) ΔH=—197kJ/mol,在相同温度下,向固定体积的密闭容器中通入2molSO2和1molO2,达到平衡时放出热量Q1;向另一个同体积的密闭容器中通入1molSO2和0.5molO2,达到平衡时放出热量为Q2,则下列关系中正确的是
A.Q2>Q1/2 B.Q2=Q1/2 C.Q2<Q1<197kJ D.Q2=Q1=197kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
pH相同的氨水、氢氧化钠和氢氧化钡溶液,分别用蒸馏水稀释到原来的X倍、Y倍、Z倍,稀释后三种溶液的pH相同,则X、Y、Z的关系是
A.X=Y=Z B.X>Y=Z C.X<Y=Z D.X=Y<Z
查看答案和解析>>
科目:高中化学 来源: 题型:
用实验确定某酸HA是弱电解质。两同学的方案是:
甲:①称取一定质量的HA配制0.lmol/L的溶液100mL;
②用pH试纸测出该溶液的pH,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=l的两种酸溶液各100mL;
②分别取这两种溶液各10mL,加水稀释为100mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
⑴在两个方案的第①步中,都要用到的定量仪器是 。
⑵甲方案中,说明HA是弱电解质的理由是测得溶液的pH 1(选填>、<、=)
乙方案中,说明HA是弱电解质的现象是 (多选扣分)
(a)装HCl溶液的试管中放出H2的速率快;
(b)装HA溶液的试管中放出H2的速率快;
(c)两个试管中产生气体速率一样快。
⑶请你再提出一个合理且比较容易进行的方案(药品可任取),作简明扼要表述 。
查看答案和解析>>
科目:高中化学 来源: 题型:
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq) I3-(aq), 某I2、KI混合溶液中, c(I3-)与温度T的关系如下图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是
I3-(aq), 某I2、KI混合溶液中, c(I3-)与温度T的关系如下图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是
A.反应 I2(aq)+I-(aq) I3-(aq) ΔH>0
I3-(aq) ΔH>0
B.若温度为T1、T2,反应的平衡常数分别为K1、K2,
则K2>K1
C.若T1时,反应进行到状态d时,一定有υ正 >υ逆
D.状态a与状态b相比,状态b时I2的转化率更高
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如下图所示(某些条件和部分产物已略去)。下列说法不正确的是( )
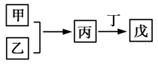
A.若甲既能与盐酸反应又能与NaOH溶液反应则丙可能属于两性氧化物
B.若甲为短周期中原子半径最大的主族元素的单质,且戊为碱,则丙只能为Na2O2
C.若丙、丁混合产生白烟,且丙为18电子分子,丁为10电子分子,则乙的水溶液可能具有漂白作用
D.若甲、丙、戊含有同一种元素,则三种物质中,该元素的化合价由低到高的顺序可能为甲<丙<戊
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com