
【题目】已知实验室用浓硫酸和乙醇在170℃的条件下制备乙烯(140℃时生成乙醚)。某学习小组设计实验证明浓硫酸在该反应中的还原产物有SO2,并制备1,2-二溴乙烷(装置可以重复使用)。
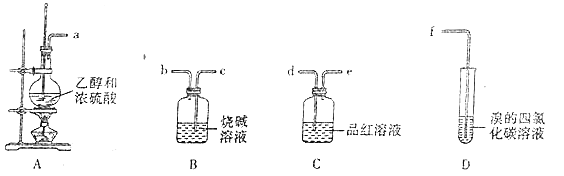
下列说法错误的是( )
A. 加热时迅速将温度升高至170℃,减少生成副产品
B. 导管接口连接顺序为a→d→e→c→b→d→e→f
C. 装置B中的试剂可以换成酸性高锰酸钾溶液
D. 实验完毕后,采用蒸馏操作分离提纯1,2-二溴乙烷
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. NaHCO3(s) ![]() Na2CO3(s)
Na2CO3(s) ![]() NaOH(aq)
NaOH(aq)
B. Al(s)![]() NaAlO2(aq)
NaAlO2(aq)![]() Al(OH)3(s)
Al(OH)3(s)
C. AgNO3(aq)![]() [Ag(NH3)2]+(aq)
[Ag(NH3)2]+(aq)![]() Ag(s)
Ag(s)
D. Fe2O3(s)![]() Fe(s)
Fe(s)![]() FeCl3(aq)
FeCl3(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第三代半导体材料氮化镓(GaN)适合于制作高温、高频、抗辐射及大功率器件,通常称为高温半导体材料。回答下列问题:
(1)基态Ga原子价层电子的轨道表达式为_______,第一电离能介于N和B之间的第二周期元素有_______种。
(2)HCN分子中σ键与π键的数目之比为_______,其中σ键的对称方式为______。与CN-互为等电子体的分子为__________。
(3)NaN3是汽车安全气囊中的主要化学成分,其中阴离子中心原子的杂化轨道类型为_________,NF3的空间构型为_________。
(4)GaN、GaP、GaAs都是很好的半导体材料,晶体类型与晶体硅类似,熔点如表所示,分析其变化原因_____________。
GaN | GaP | GaAs | |
熔点 | 1700℃ | 1480℃ | 1238℃ |
(5)GaN晶胞结构如图所示:晶胞中Ga原子采用六方最密堆积方式,每个Ga原子周围距离最近的Ga原子数目为_________;


查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学小组学生利用如图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl36H2O晶体。(图中夹持及尾气处理装置均已略去)

(1)装置B中发生反应的化学方程式是______。
(2)装置E中的现象是______。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。写出可能发生的有关反应化学方程式:______。
(4)该小组学生利用上述滤液制取FeCl36H2O晶体,设计流程如图所示:
![]()
①步骤I中通入Cl2的作用是________。
②简述检验滤液中Fe3+的操作方法_______。
③步骤Ⅱ从FeCl3稀溶液中得到FeCl36H2O晶体的主要操作包括:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】采用电化学法还原CO2是一种使CO2资源化的方法。下图是利用此法制备ZnC2O4的示意图(电解液不参与反应)。下列说法中正确的是

A. Zn与电源的负极相连
B. ZnC2O4在交换膜右侧生成
C. 电解的总反应为2CO2+Zn![]() ZnC2O4
ZnC2O4
D. 通入11.2 L CO2时,转移0.5 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将Na2A和NaHA溶液分别进行稀释,若-lg c(Na+)=pNa、-lgc(OH-)=pOH,则测得两种溶液中pNa与pOH的关系曲线如图。下列说法正确的是( )
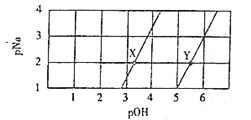
A. X点所在的直线表示NaHA溶液的稀释
B. 在Y点加入适量NaOH固体可以达到X点
C. 将X和Y点溶液等体积混合,则有c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+)
D. 常温下,H2A的Ka1数量级为10-5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯达莫司汀是一种抗癌药物。其中一种合成苯达莫司汀中间体H的路线如图:

已知:RCH== CHR’![]() RCOOH+R’COOH
RCOOH+R’COOH
(1)C的命名是____,H中含氧官能团是___(填名称)。
(2)E的结构简式是______,C到D的反应类型是______。
(3)写出B→C的化学方程式:______。
(4)M是 的同分异构体,M能发生银镜反应,和NaHCO3反应产生气体,M可能有___种,若分子中只有3种不同化学环境的氢,则符合条件的M的结构简式是_____。
的同分异构体,M能发生银镜反应,和NaHCO3反应产生气体,M可能有___种,若分子中只有3种不同化学环境的氢,则符合条件的M的结构简式是_____。
(5)请写出以![]() 和适当的无机试剂为原料制备
和适当的无机试剂为原料制备![]() 的合成路线流程图:_____。
的合成路线流程图:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:

回答下列问题:
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3![]() Na2CrO4+ Fe2O3+CO2+ NaNO2
Na2CrO4+ Fe2O3+CO2+ NaNO2
上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是________________。
(2)滤渣1中含量最多的金属元素是____________,滤渣2的主要成分是_____________及含硅杂质。
(3)步骤④调滤液2的pH使之变____________(填“大”或“小”),原因是___________________(用离子方程式表示)。
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到___________(填标号)得到的K2Cr2O7固体产品最多。

a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是___________________。
(5)某工厂用m1 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品 m2 kg,产率为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,分别对反应C(s)+CO2(g)![]() 2CO(g)(ΔH>0)进行如下操作(只改变该条件):①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积;④减少体系中CO的量。上述措施中一定能使反应速率显著变大的是
2CO(g)(ΔH>0)进行如下操作(只改变该条件):①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积;④减少体系中CO的量。上述措施中一定能使反应速率显著变大的是
A.①②③④B.①③④C.①②D.①③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com