
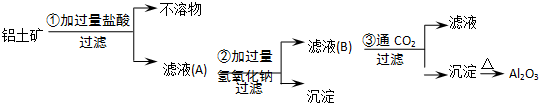
分析 铝土矿的主要成分是Al2O3•xH2O、Fe2O3、SiO2 等,由流程可知,先加过量盐酸,SiO2和盐酸不反应,滤液中含铁离子、铝离子,再加氢氧化钠溶液,沉淀为氢氧化铁,滤液B为偏铝酸钠,向偏铝酸钠中通入过量的二氧化碳可以生成氢氧化铝沉淀,沉淀氢氧化铝加热生成氧化铝,以此来解答.
解答 解:铝土矿的主要成分是Al2O3•xH2O、Fe2O3、SiO2 等,由流程可知,先加过量盐酸,SiO2和盐酸不反应,滤液中含铁离子、铝离子,再加氢氧化钠溶液,沉淀为氢氧化铁,滤液B为偏铝酸钠,向偏铝酸钠中通入过量的二氧化碳可以生成氢氧化铝沉淀,沉淀氢氧化铝加热生成氧化铝,
(1)氧化铝与盐酸反应生成氯化铝和水,反应方程式为Al2O3+6HCl═2AlCl3+3H2O,
氧化铁与盐酸反应生成氯化铁与水,反应方程式为 Fe2O3+6HCl═2Fe2Cl3+3H2O.
氯化铝与氢氧化钠反应生成四羟基合铝酸钠与氯化钠,反应方程式为AlCl3+4NaOH═Na〔Al(OH)4〕+3NaCl,
氯化铁与氢氧化钠反应生成氢氧化铁和氯化钠,反应方程式为FeCl3+3NaOH═Fe(OH)3↓+3NaCl.
①在滤液A中加过量NaOH的离子反应为Al3++4OH-═[Al(OH)4]-、Fe3++3OH-═Fe(OH)3↓,
故答案为:Al3++4OH-═[Al(OH)4]-、Fe3++3OH-═Fe(OH)3↓;
②在滤液B中通入适量CO2的离子反应为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(2)电解熔融的Al2O3的化学方程式是2Al2O3$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑,故答案为:2Al2O3$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑.
点评 本题考查混合物分离提纯,侧重于学生的分析能力的考查,为高考常见题型,注意把握流程中的反应为解答该类题目的关键,注意元素化合物知识的综合应用,题目难度不大.


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | K+、Br-、CO32-、OH- | B. | H+、Br-、ClO-、SO42-、Na+ | ||
| C. | SO42-、Br-、H+、Fe3+ | D. | Br-、SO32-、OH-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
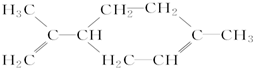
| A. | 柠檬烯的分子式为C10H16,能使溴的四氯化碳溶液褪色 | |
| B. | 柠檬烯分子为非极性分子 | |
| C. | 柠檬烯分子中所有碳原子处于同一个平面上 | |
| D. | 柠檬烯能与酸性高锰酸钾溶液发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L二氯甲烷的分子数约为NA个 | |
| B. | 过氧化钠与水反应时,每生成0.1mol氧气转移的电子数为0.4NA | |
| C. | 电解精炼铜时,若阴极得到的电子数为2NA,则阳极质量减少64g | |
| D. | 3.2g由氧气和臭氧组成的混合物中含有氧原子的数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
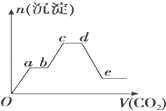 将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与所通入CO2的体积关系如图所示.下列关于整个反应过程中的叙述不正确的是( )
将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与所通入CO2的体积关系如图所示.下列关于整个反应过程中的叙述不正确的是( )| A. | Oa段反应的化学方程式是Ba(OH)2+CO2═BaCO3↓+H2O | |
| B. | ab段与cd段沉淀质量都不变,但所发生的反应不相同 | |
| C. | bc段反应的离子方程式是:2AlO2-+3H2O+CO2═2Al(OH)3↓+CO32- | |
| D. | de段沉淀减少是由于Al(OH)3固体消失的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 | |
| B. | 当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用 | |
| C. | 纯银器表面在空气中因电化学腐蚀渐渐变暗 | |
| D. | 金属腐蚀的电化学腐蚀,是利用了原电池原理,但原电池原理不能用于金属防护 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
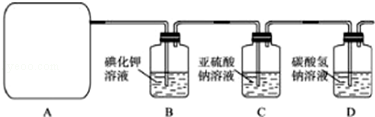

查看答案和解析>>
科目:高中化学 来源: 题型:解答题



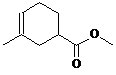 、
、 .
.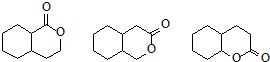 任意一种.
任意一种.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com