
| A. | 用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| B. | 用双氧水和稀硫酸处理印刷电路板:Cu+H2O2+2H+=Cu2++2H2O | |
| C. | NaHCO3溶液中加足量Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+H2O+CO32- | |
| D. | 氯气溶于水:Cl2+H2O=2H++Cl-+ClO- |
分析 A.醋酸为弱酸应保留化学式;
B.过氧化氢具有氧化性能氧化铜生成铜离子;
C.氢氧化钡足量,反应生成碳酸钡、氢氧化钠和水;
D.次氯酸为弱酸,应保留化学式.
解答 解:A.用CH3COOH溶解CaCO3,离子方程式:CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO-,故A错误;
B.用双氧水和稀硫酸处理印刷电路板,离子方程式:Cu+H2O2+2H+=Cu2++2H2O,故B正确;
C.NaHCO3溶液中加足量Ba(OH)2溶液,离子方程式:HCO3-+Ba2++OH-=BaCO3↓+H2O,故C错误;
D.氯气溶于水,离子方程式:Cl2+H2O=H++Cl-+HClO,故D错误;
故选:B.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,注意化学式的拆分、注意反应物用量对反应的影响.


科目:高中化学 来源: 题型:选择题
| A. | 凡是吸热反应都需要加热 | |
| B. | 物质的化学变化都伴随着能量变化 | |
| C. | 表示中和热的热化学方程式:NaOH+HCl═NaCl+H2O△H=-57.3 kJ•mol-1 | |
| D. | 等质量的硫蒸气和硫固体分别完全燃烧,前者的反应热比后者大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | J | F | H |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
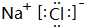 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
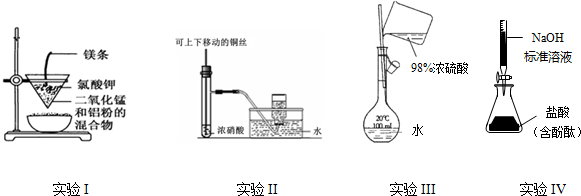
| A. | 实验I:制备金属锰 | |
| B. | 实验II:制备并收集NO2 | |
| C. | 实验III:配置一定的物质的量浓度的稀硫酸溶液 | |
| D. | 实验IV:测定未知盐酸的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
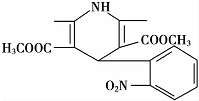
| A. | 该化合物的分子式为C17H17N2O6 | |
| B. | 该化合物的分子中含有三种不同的官能团 | |
| C. | 该化合物能与氢气发生加成反应,但不能与溴的四氯化碳溶液反应 | |
| D. | 该化合物能发生水解反应、聚合反应、取代反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com