
【题目】在一密闭容器中,反应 aA(g)![]() bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的40%,则 ( )
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的40%,则 ( )
A.物质B的质量分数减小了B.平衡向逆反应方向移动了
C.平衡向正反应方向移动了D.a>b
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某同学为研究电化学原理,使用KCl盐桥设计如图所示实验装置.下列分析不合理的是![]()
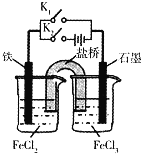
A.闭合![]() 断开
断开![]() ,左侧烧杯中的
,左侧烧杯中的![]() 向铁电极移动
向铁电极移动
B.无论闭合![]() ,断开
,断开![]() ,还是断开
,还是断开![]() ,闭合
,闭合![]() ,石墨电极上发生的反应都是
,石墨电极上发生的反应都是![]()
C.闭合![]() ,断开
,断开![]() ,电流从石墨电极经过
,电流从石墨电极经过![]() 流向铁电极
流向铁电极
D.闭合![]() ,断开
,断开![]() ,左侧烧杯中的溶液pH将逐渐降低
,左侧烧杯中的溶液pH将逐渐降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中充入3 mol A和2 mol B发生如下反应:3A(g)+B(g)![]() xC(g)。该反应达到平衡后,C的体积分数为W%。若维持容器的容积和温度不变,按起始物质的量A 0.6 mol、B 1.2 mol、C 1.6 mol充入容器达到平衡后,C的体积分数还为W%。则x的值( )
xC(g)。该反应达到平衡后,C的体积分数为W%。若维持容器的容积和温度不变,按起始物质的量A 0.6 mol、B 1.2 mol、C 1.6 mol充入容器达到平衡后,C的体积分数还为W%。则x的值( )
A. 只能为2 B. 只能为4 C. 可能为2,可能为4 D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )

下列图示与对应的叙述符合的是( )
A.图甲实线、虚线分别表示某可逆反应未使用催化剂和使用催化剂的正、逆反应速率随时间的变化
B.图乙表示反应2SO2(g)+O2(g) ![]() 2SO3(g)△H<0的平衡常数K与温度和压强的关系
2SO3(g)△H<0的平衡常数K与温度和压强的关系
C.图丙表示向0.1mol/L的NH4Cl溶液中滴加0.1mol/L的HCl溶液时,溶液中 随HCl溶液体积变化关系
随HCl溶液体积变化关系
D.图丁表示常温下向20mL pH=3的醋酸中滴加pH=11的NaOH溶液,溶液的pH随NaOH溶液体积的变化关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下纯水中的c(H+)=2×10-7mol/L,对此下列说法正确的是( )
A.若向水中加入少量盐酸,则水的电离度减小
B.该温度低于25℃
C.此温度下水的离子积为常温下的两倍
D.据此无法求算水中c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.用标准NaOH溶液滴定充满HCl的烧瓶(标况下,烧瓶容积为V L)做完喷泉实验后得到的稀盐酸(水充满整个烧瓶)以测定它的准确浓度,用酚酞作指示剂。请你回答下列问题:
(1)计算该盐酸的物质的量浓度为:_____。(保留三位有效数字)
(2)现有三种浓度的标准NaOH溶液,你认为最合适的是下列第_____种。
①5.00molL﹣1②0.500molL﹣1③0.0500molL﹣1
(3)若采用上述最合适浓度的标准NaOH溶液滴定,滴定时实验数据列表如下:
实验次数编号 | 待测盐酸体积(mL) | 滴入NaOH溶液体积(mL) |
1 | 10.00 | 8.48 |
2 | 10.00 | 8.52 |
3 | 10.00 | 8.00 |
求这种待测稀盐酸的物质的量浓度c(HCl)=_____。与理论计算值比较,造成的误差的原因可能是哪些下列操作导致的_____
①滴定前平视,滴定终了俯视
②滴定管(装标准溶液)在滴定前尖嘴处有气泡,滴定终了无气泡
③滴定管用蒸馏水洗净后,未用已知浓度的标准溶液润洗
④看到颜色变化后立即读数 ⑤洗涤锥形瓶时,误把稀食盐水当做蒸馏水进行洗涤
II.测定绿矾FeSO4·xH2O中结晶水含量
Ⅰ.准确称量27.8 g绿矾样品,配成250 mL溶液;
Ⅱ.量取25.00 mL所配制的溶液于锥形瓶中;
Ⅲ.用硫酸酸化的0.100 0 mol·L1 KMnO4溶液滴定至终点;
Ⅳ.重复操作3次,消耗KMnO4溶液的体积分别为20.02 mL、24.98 mL、19.98 mL。
(1)判断达到滴定终点时的实验现象是_____。
(2)根据实验记录,计算绿矾化学式中结晶水数目x=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式中,不能正确表达反应颜色变化的是
A. 向CuSO4溶液中加入足量Zn粉,溶液蓝色消失Zn+CuSO4![]() Cu+ZnSO4
Cu+ZnSO4
B. 澄清的石灰水久置后出现白色固体Ca(OH)2+CO2![]() CaCO3↓+H2O
CaCO3↓+H2O
C. Na2O2在空气中放置后由淡黄色变为白色2Na2O2![]() 2Na2O+O2↑
2Na2O+O2↑
D. 向Mg(OH)2悬浊液中滴加足量FeCl3溶液出现红褐色沉淀3Mg(OH)2+2FeCl3![]() 2Fe(OH)3+3MgCl2
2Fe(OH)3+3MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在25 mL0.1mol/L的NaOH溶液中,逐滴加入0.2 mol/L的CH3COOH溶液,溶液的pH与CH3COOH 溶液体积关系如图所示。下列有关粒子浓度关系正确的是

A. 曲线上A、B间的任意一点:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B. B点:c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C. C点:c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
D. D点:c(CH3COO-)+c(CH3COOH)=2c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
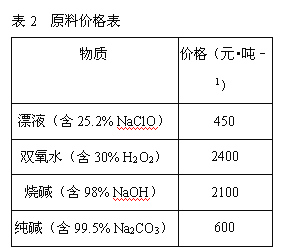
【题目】卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子.若以它以及表2中的某些物质为原料,按图所示工艺流程进行生产,可制得轻质氧化镁。
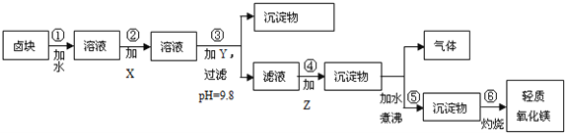
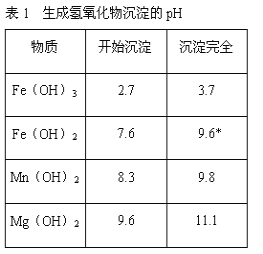
若要求产品尽量不含杂质,而且生产成本较低,请根据表1和表2提供的资料,填写空白:(注*Fe2+氢氧化物呈絮状,不易从溶液中除去,所以,常将它氧化为Fe3+,生成Fe(OH)3沉淀除去)。
(1)铁元素位于 第____族____区,其中Fe2+ 核外电子排布式为____,
(2)在步骤②中加入的试剂X,最佳的选择是__________,写出步骤②中pH=1时所发生反应的离子方程式:__________;
(3)在步骤③中加入的试剂是____;之所以要控制pH=9.8,其目的是_______;
(4)已知在步骤⑤中发生的反应是____,写出步骤⑥的化学方程式_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com