
【题目】某同学为检验某溶液中是否含有常见的四种无机离子,进行了如图所示的实验操作.其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝.由该实验能得到的正确结论是( ) 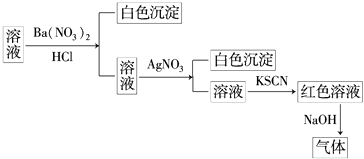
A.原溶液中一定含有SO42﹣
B.原溶液中一定含有NH4+
C.原溶液中一定含有Cl﹣
D.原溶液中一定含有Fe3+
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
【题目】有机物A由碳、氢、氧三种元素组成.现取2.3gA与2.8L氧气(标准状况)在密闭容器中燃烧,燃烧后生成二氧化碳、一氧化碳和水蒸气(假设反应物没有剩余).将反应生成的气体依次通过浓硫酸和碱石灰,浓硫酸增重2.7g,碱石灰增重2.2g.回答下列问题:
(1)2.3g A中所含氢原子、碳原子的物质的量各是多少?
(2)通过计算确定该有机物的分子式;
(3)试写出该有机物可能的结构简式.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
(1)该反应中的氧化剂与还原剂的物质的量之比是 .
(2)如反应中转移了2mol电子,则产生的Cl2在标准状况下的体积为多少?
(3)产生的KCl若配成1L的溶液,其物质的量浓度应为多少?
<注:第(2)、(3)小题必须写出计算过程>
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种单核微粒:①当A微粒失去3个电子后,电子层结构与氖原子的相同;②B微粒得到一个电子后,其电子层结构与氩原子相同;③C微粒带两个单位正电荷,在周期表中与A左右相邻;④D微粒有18个电子,与自然界中含量最多的元素位于同一主族.请回答:
(1)写出各微粒的符号:A、B、C、D .
(2)B微粒的结构示意图为;D微粒的核外电子排布式为 .
(3)四种元素第一电离能的大小顺序为: .
(4)四种元素电负性的大小顺序为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲将氯化钠、沙子(主要成分为SiO2)、碘三种物质组成的固体混合物分离,最科学的操作顺序是( )
A.溶解、过滤、加热(升华)、蒸发(结晶)
B.加热(升华)、溶解、过滤、蒸发(结晶)
C.加热(升华)、溶解、蒸馏、结晶
D.溶解、结晶、过滤、加热(升华)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化中发生加成反应的是( )
A. 将苯滴入溴水中,振荡后水层接近无色
B. 乙烯使酸性高锰酸钾溶液褪色
C. 乙烯通入溴水中,溴水褪色
D. 光照下甲烷与氯气的混合气体颜色逐渐变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于羟基和氢氧根的说法中,不正确的是( )
A. 羟基比氢氧根少一个电子
B. 两者的组成元素相同
C. 羟基不带电,氢氧根带一个单位负电荷
D. 羟基比氢氧根稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用 Na2CO3和 KHCO3 组成的某混合物进行实验,测得如表数据(盐酸的物质的量浓度相等且不考虑HCl的挥发)下列有关的说法中,正确的是( )
实验序号 | ① | ② | ③ | ④ |
盐酸体积/mL | 50 | 50 | 50 | 50 |
固体质量/g | 3.06 | 6.12 | 9.18 | 12.24 |
生成气体体积/L(标况) | 0.672 | 1.344 | 1.568 | 1.344 |
A.盐酸的物质的量浓度为 2 molL﹣1
B.原混合物样品中 n(Na2CO3):n(KHCO3)=1:1
C.实验②中,混合物过量
D.实验④反应后,至少需继续加入 40ml 的该盐酸溶液才能把12.24g 的混合物全部反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫和氮氧化物是形成酸雨、雾霾等环境污染的罪魁祸首,采用合适的措施消除其污染是保护环境的重要举措.
(1)研究发现利用NH3可消除硝酸尾气中的NO污染.NH3与NO的物质的量之比分别为1﹕3、3﹕1、4﹕1时,NO脱除率随温度变化的曲线如图所示: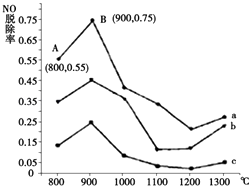
①用化学反应方程式表示NH3消除NO的反应原理(不用注明反应条件).
②曲线b 对应NH3与NO的物质的量之比是 .
③曲线a中,NO的起始浓度为6×10﹣4mg/m3 , 从A点到B点经过0.8s,该时间段内NO的脱除速率为 mg/(m3s).
(2)NO、NO2混合气体能被NaOH溶液吸收生成NaNO2和NaNO3 , 若吸收的溶液中NO2﹣的浓度为agL﹣1 , 要使1m3该溶液中的NO2﹣完全转化为NH4NO3 , 至少需通入标准状况下的O2L.(用含a的代数式表示,计算结果保留整数)
(3)SO2被少许NaOH溶液吸收生成能使pH试纸变红的NaHSO3溶液,工业上可电解NaHSO3得到重要化工产品Na2S2O4 .
①NaHSO3溶液中离子浓度大小为 .
②写出生成S2O42﹣的电极反应式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com